【刚刚发布】台湾出台《细胞和基因治疗产品管理法(草案)》(附全文)
| 导读 | 台湾食药署发布「细胞及基因治疗产品管理法」草案,明定细胞及基因治疗产品的定义,并规范捐赠者合适性,另也在确保安全状况下核淮暂时性许可证,给癌症末期、无药可医的患者治疗希望,预计草案将于年底前送行政院。
|

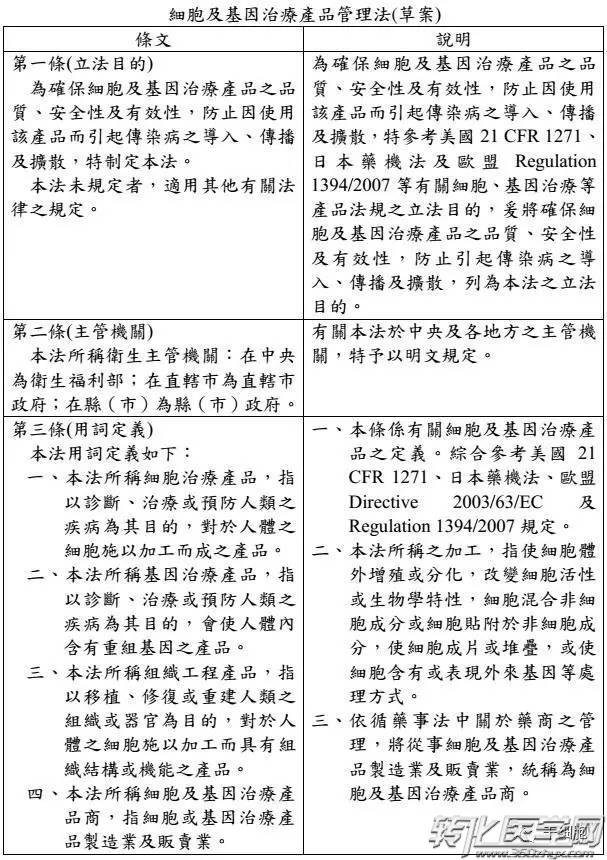
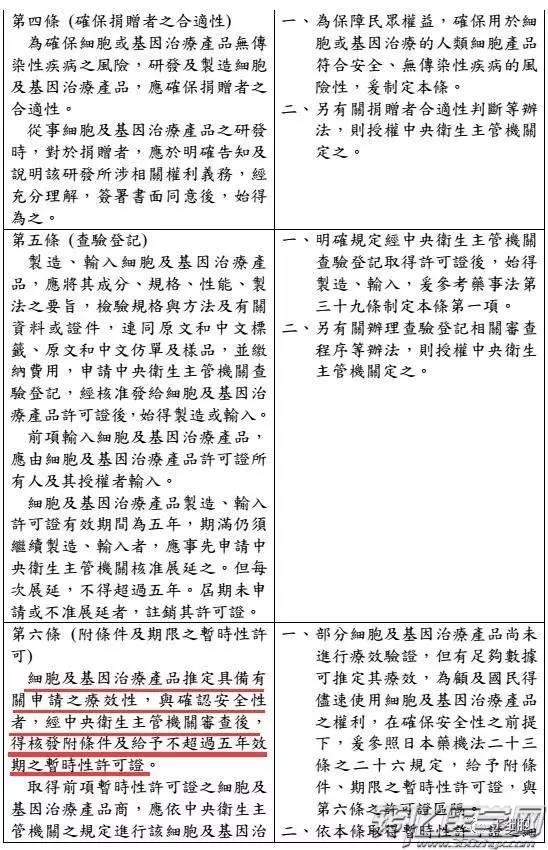
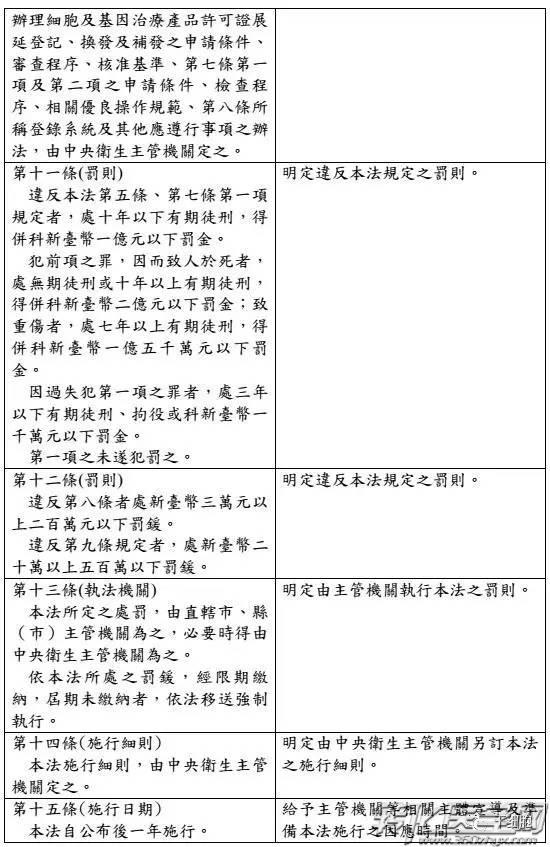
台湾食药署发布「细胞及基因治疗产品管理法」草案,明定细胞及基因治疗产品的定义,并规范捐赠者合适性,另也在确保安全状况下核淮暂时性许可证,给癌症末期、无药可医的患者治疗希望,预计草案将于年底前送行政院。
另,细胞与基因治疗要上市必须通过三期临床试验,并通过审核,但有些患者情况紧急,因此设定出暂时性许可证机制,只要确认捐赠者合适性,并使细胞或基因治疗产品无传染性疾病的风险、确保安全性的前提,不一定要完成三期试验也能核淮暂时许可使用。
现今医疗技术或药物无法治癒的病人,往往视细胞治疗、基因治疗等新产品为最后的救命解药,但碍于台湾法规限制严格,病人得面对冗长繁琐的核淮程序,食药署今日宣布鬆绑,正式预告「细胞及基因治疗产品管理法」草案,其中设立「暂时许可」机制,病人在药品未核淮上市前也能抢先用药。
祁若凤说,像不少细胞及基因治疗产品都牵涉到捐赠者的合适性问题,若品质管理不当,极易衍生感染风险,这部专法就可提供确保细胞及基因治疗产品品质、安全及疗效的法律规范,促进病人接受新兴产品治疗权利。




(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发