精准医疗时代的乳腺癌研究
| 导读 | 下一代测序技术揭示了不同癌症的遗传背景,也为发现新的癌症相关的遗传变异和研究这些变异的功能提供了依据。我们已经进入实施精准医疗的理想时代,但是尽管精准医疗具有令人兴奋的潜力,目前仅有少数几种疾病和分子亚型可以提供有效的治疗。其中一个例子就是抗人表皮生长因子受体2(HER2)阳性乳腺癌的靶向治疗。
|
下一代测序技术揭示了不同癌症的遗传背景,也为发现新的癌症相关的遗传变异和研究这些变异的功能提供了依据。我们已经进入实施精准医疗的理想时代,但是尽管精准医疗具有令人兴奋的潜力,目前仅有少数几种疾病和分子亚型可以提供有效的治疗。其中一个例子就是抗人表皮生长因子受体2(HER2)阳性乳腺癌的靶向治疗。
乳腺癌是在妇女中诊断出的最常见的癌症,大约八分之一的生活在美国的女性具有终生患病风险。乳腺癌也是研究最多的实体瘤之一,并且可以用精准医疗的方法来进行防治。乳腺癌是异质性肿瘤。根据基因表达图谱,乳腺癌可以分为几种分子亚型,包括管腔乳腺癌,HER2阳性乳腺癌和三阴性乳腺癌(TNBC)。不同亚型具有不同的肿瘤生物学特征和治疗策略。不同的基因表达和突变谱、不同的预后和对治疗的反应均与不同的内在亚型相关。在精准医疗时代,科学家们致力于开发基于分子亚型的治疗方法。在此,我们总结了治疗所谓的“难治性”乳腺癌的主要挑战和可能的解决方案。
宫腔乳腺癌的晚期复发可以进一步分为Luminal A和Luminal B两种亚型。两种亚型都与雌激素受体(ER)的高表达相关。它们通常对内分泌治疗有反应,但对化疗反应较差。两种亚型中的突变基因包括PIK3CA,CDH1,MAP3K1,GATA3,MAP2K4,FOXA1,TP53,PTEN和RUNX1。Luminal A亚型的特征在于低病理分级,高分化和低增殖率。该亚型的复发突变基因数目最多,每个肿瘤的突变总数最低,表明这些变异可能是驱动突变。Luminal B亚型比Luminal A亚型的孕酮受体(PR)水平更低,而Ki-67表达水平更高。Luminal B肿瘤对新型辅助化疗具有更高的缓解率,并且可能比Luminal A肿瘤对辅助化疗更敏感。
管腔乳腺癌约占所有乳腺癌病例的三分之二。 与TNBC和HER2阳性乳腺癌相比,管腔乳腺癌具有更多的治疗选择,包括激素治疗和HER2靶向治疗。然而,在经历5年的辅助激素治疗后,患有管腔乳腺癌的病人在诊断后至少15年内具有疾病复发和死亡的持续风险。管腔乳腺癌会诱发许多高度异质性的疾病,并且每个患者的预后是高度可变的。因此,鉴别晚期复发和预后不良的高风险的患者对于运用进一步的治疗是十分重要的。通过分子生物标志物和传统的clini-copathological特征的结合可以进一步将管腔乳腺癌细分到亚类,这些亚类可以显示出不同的内分泌的敏感性和治疗结果。
HER2阳性乳腺癌中靶向治疗的抗性
HER2阳性乳腺癌的特征在于高水平的HER2基因扩增和低水平的ER或PR表达。与其他亚型相比,HER2阳性乳腺癌的单核苷酸突变率最高,复发突变基因也很多(其中TP53和PIK3CA最常突变)。这些肿瘤通常具有高的病理分级和高的脑转移率。它们对佐剂蒽环霉素和紫杉烷类敏感,并且它们通常对(新)佐剂曲妥珠单抗(HER2靶向治疗)联合化疗有反应。
虽然HER2靶向治疗具有相当大的疗效,如利用曲妥珠单抗和拉帕替尼治疗HER2阳性乳腺癌患者,但临床医生和研究人员越来越多地观察到HER2阳性乳腺癌患者的原发性和获得性耐药性,这使得HER2靶向药物的临床价值降低。研究人员已经对促成曲妥珠单抗和拉帕替尼耐药性的分子机制进行了广泛的研究,包括其他HER家族受体及其配体的过表达或高表达,PI3KCA突变,AKT突变或扩增,以及磷酸酶和张力蛋白同源物(PTEN) 表达,所有这些都导致PI3K / Akt / mTOR途径的扩增。最近,我们揭示了HER2激酶结构域中的突变可能是引起HER2靶向治疗抗性的关键机制,并且不可逆的酪氨酸激酶抑制剂例如neratinib可能可以提供替代性治疗选择。使用panomics解决方案,研究人员能够进一步确定综合耐药机制和对抗HER2靶向治疗耐药性的方法。
TNBC异质性和药物靶点的缺乏
TNBC占所有乳腺癌的10%-20%,其缺乏ER和PR表达以及HER2扩增。一般来说,TNBC在年轻患者中出现得频率更高,肿瘤尺寸更大,具有更高的分级,更有可能伴随淋巴结的参与,并且在生物学上更具侵袭性。这种乳腺癌亚型与BRCA1种系突变相关,同时TP53是唯一复发性突变基因。化疗是TNBC的主要疗法。尽管TNBC对新辅助化疗的临床反应率增加,与其他乳腺癌亚型,TNBC仍具有较高的远端转移率和较差的预后。
根据Lehmann / Pietenpol分类方法,TNBC可以进一步细分为七种类型。疾病的异质性和分子靶标的缺乏是TNBC治疗所面临的挑战。相似的化疗策略可能引起TNBC患者的不同反应和临床结果。目前没有在诊断时对TNBC患者之间的差异进行分类的方法。因此,对该侵略性疾病亚型进行进一步分类以便更好地给患者制定治疗策略是至关重要的。同时,确定TNBC患者特异性的生物标志物和药物靶点将显著提高精准治疗效率。基本并行测序和其他组学技术已经鉴定出了一些TNBC类型的潜在的分子特征,例如胚系BRCA1 / 2突变,雄激素受体的高表达和几种罕见的基因组变异。最近,全面的转录物组分析使我们能够开发一个新的TNBC分类系统,识别亚型特异性长非编码RNA,这些RNA可能是有效的生物标志物和治疗靶点。
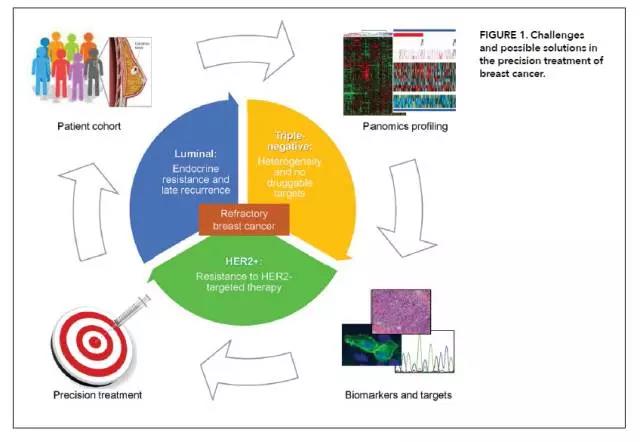 上述挑战是目前乳腺癌治疗中最关键的一些问题。多组学驱动的癌症药物的实施可能有助于克服这些挑战。首先,应该建立一个高质量、有代表性的患者队列;第二,应使用最先进的技术来表征患者肿瘤的panomics数据概况;第三,组学数据应该使用现有和新兴抗癌药物的知识库进行过滤,以识别潜在的靶点和预测/预后生物标志物;最后,应该将可以纳入临床决策的注释列表呈现给治疗肿瘤学家。
上述挑战是目前乳腺癌治疗中最关键的一些问题。多组学驱动的癌症药物的实施可能有助于克服这些挑战。首先,应该建立一个高质量、有代表性的患者队列;第二,应使用最先进的技术来表征患者肿瘤的panomics数据概况;第三,组学数据应该使用现有和新兴抗癌药物的知识库进行过滤,以识别潜在的靶点和预测/预后生物标志物;最后,应该将可以纳入临床决策的注释列表呈现给治疗肿瘤学家。
我们正进入一个令人兴奋的时代,一个可以根据患者的肿瘤遗传学信息和对药物的反应来为他们提供精准治疗方案的时代。精准医疗具有广阔前景,而且随着基于生物标志物的新疗法的开发和早期癌症检测的持续进展,我们可以预测,未来治疗方法将得到巨大改善,患者将会得到更好的治疗效果。(转化医学网360zhyx.com)
乳腺癌是在妇女中诊断出的最常见的癌症,大约八分之一的生活在美国的女性具有终生患病风险。乳腺癌也是研究最多的实体瘤之一,并且可以用精准医疗的方法来进行防治。乳腺癌是异质性肿瘤。根据基因表达图谱,乳腺癌可以分为几种分子亚型,包括管腔乳腺癌,HER2阳性乳腺癌和三阴性乳腺癌(TNBC)。不同亚型具有不同的肿瘤生物学特征和治疗策略。不同的基因表达和突变谱、不同的预后和对治疗的反应均与不同的内在亚型相关。在精准医疗时代,科学家们致力于开发基于分子亚型的治疗方法。在此,我们总结了治疗所谓的“难治性”乳腺癌的主要挑战和可能的解决方案。
宫腔乳腺癌的晚期复发可以进一步分为Luminal A和Luminal B两种亚型。两种亚型都与雌激素受体(ER)的高表达相关。它们通常对内分泌治疗有反应,但对化疗反应较差。两种亚型中的突变基因包括PIK3CA,CDH1,MAP3K1,GATA3,MAP2K4,FOXA1,TP53,PTEN和RUNX1。Luminal A亚型的特征在于低病理分级,高分化和低增殖率。该亚型的复发突变基因数目最多,每个肿瘤的突变总数最低,表明这些变异可能是驱动突变。Luminal B亚型比Luminal A亚型的孕酮受体(PR)水平更低,而Ki-67表达水平更高。Luminal B肿瘤对新型辅助化疗具有更高的缓解率,并且可能比Luminal A肿瘤对辅助化疗更敏感。
管腔乳腺癌约占所有乳腺癌病例的三分之二。 与TNBC和HER2阳性乳腺癌相比,管腔乳腺癌具有更多的治疗选择,包括激素治疗和HER2靶向治疗。然而,在经历5年的辅助激素治疗后,患有管腔乳腺癌的病人在诊断后至少15年内具有疾病复发和死亡的持续风险。管腔乳腺癌会诱发许多高度异质性的疾病,并且每个患者的预后是高度可变的。因此,鉴别晚期复发和预后不良的高风险的患者对于运用进一步的治疗是十分重要的。通过分子生物标志物和传统的clini-copathological特征的结合可以进一步将管腔乳腺癌细分到亚类,这些亚类可以显示出不同的内分泌的敏感性和治疗结果。
HER2阳性乳腺癌中靶向治疗的抗性
HER2阳性乳腺癌的特征在于高水平的HER2基因扩增和低水平的ER或PR表达。与其他亚型相比,HER2阳性乳腺癌的单核苷酸突变率最高,复发突变基因也很多(其中TP53和PIK3CA最常突变)。这些肿瘤通常具有高的病理分级和高的脑转移率。它们对佐剂蒽环霉素和紫杉烷类敏感,并且它们通常对(新)佐剂曲妥珠单抗(HER2靶向治疗)联合化疗有反应。
虽然HER2靶向治疗具有相当大的疗效,如利用曲妥珠单抗和拉帕替尼治疗HER2阳性乳腺癌患者,但临床医生和研究人员越来越多地观察到HER2阳性乳腺癌患者的原发性和获得性耐药性,这使得HER2靶向药物的临床价值降低。研究人员已经对促成曲妥珠单抗和拉帕替尼耐药性的分子机制进行了广泛的研究,包括其他HER家族受体及其配体的过表达或高表达,PI3KCA突变,AKT突变或扩增,以及磷酸酶和张力蛋白同源物(PTEN) 表达,所有这些都导致PI3K / Akt / mTOR途径的扩增。最近,我们揭示了HER2激酶结构域中的突变可能是引起HER2靶向治疗抗性的关键机制,并且不可逆的酪氨酸激酶抑制剂例如neratinib可能可以提供替代性治疗选择。使用panomics解决方案,研究人员能够进一步确定综合耐药机制和对抗HER2靶向治疗耐药性的方法。
TNBC异质性和药物靶点的缺乏
TNBC占所有乳腺癌的10%-20%,其缺乏ER和PR表达以及HER2扩增。一般来说,TNBC在年轻患者中出现得频率更高,肿瘤尺寸更大,具有更高的分级,更有可能伴随淋巴结的参与,并且在生物学上更具侵袭性。这种乳腺癌亚型与BRCA1种系突变相关,同时TP53是唯一复发性突变基因。化疗是TNBC的主要疗法。尽管TNBC对新辅助化疗的临床反应率增加,与其他乳腺癌亚型,TNBC仍具有较高的远端转移率和较差的预后。
根据Lehmann / Pietenpol分类方法,TNBC可以进一步细分为七种类型。疾病的异质性和分子靶标的缺乏是TNBC治疗所面临的挑战。相似的化疗策略可能引起TNBC患者的不同反应和临床结果。目前没有在诊断时对TNBC患者之间的差异进行分类的方法。因此,对该侵略性疾病亚型进行进一步分类以便更好地给患者制定治疗策略是至关重要的。同时,确定TNBC患者特异性的生物标志物和药物靶点将显著提高精准治疗效率。基本并行测序和其他组学技术已经鉴定出了一些TNBC类型的潜在的分子特征,例如胚系BRCA1 / 2突变,雄激素受体的高表达和几种罕见的基因组变异。最近,全面的转录物组分析使我们能够开发一个新的TNBC分类系统,识别亚型特异性长非编码RNA,这些RNA可能是有效的生物标志物和治疗靶点。

我们正进入一个令人兴奋的时代,一个可以根据患者的肿瘤遗传学信息和对药物的反应来为他们提供精准治疗方案的时代。精准医疗具有广阔前景,而且随着基于生物标志物的新疗法的开发和早期癌症检测的持续进展,我们可以预测,未来治疗方法将得到巨大改善,患者将会得到更好的治疗效果。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发