伯豪客户《Cell stem cell》报道代谢调控新机制
| 导读 | ESC在体外可无限自我更新和分化为机体内任何种类的细胞,在器官再生和细胞替代治疗中具有广阔的应用前景。然而,hESC维持自我更新及发育多能性的分子调控机制还有很多问题尚不清楚,妨碍了将其分化的细胞安全有效地应用于临床。因此,对人ESC如何维持其自身特性的机制进行深入的研究尤为重要。
|
研究思路
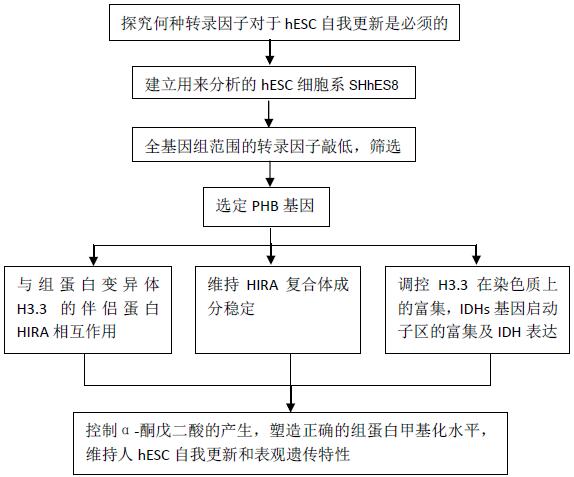
研究结果
1.全基因组范围转录因子siRNA文库筛选
研究者首先获得了一种hESC细胞株SHhES8,然后对此进行了改造,最终得到了一种hESC报告细胞系。这种细胞系含有OCT4调控转录的GFP模块。研究者根据已经公开报道的数据库中转录因子信息,进行全基因组范围转录因子siRNA筛选。通过筛选得到了25种候选对于hESC自我更新重要的转录因子,其中OCT4,RUCBL2和SFRS2已经被报道。本研究揭示了很多新的对于hESC维持自我更新重要的转录因子。
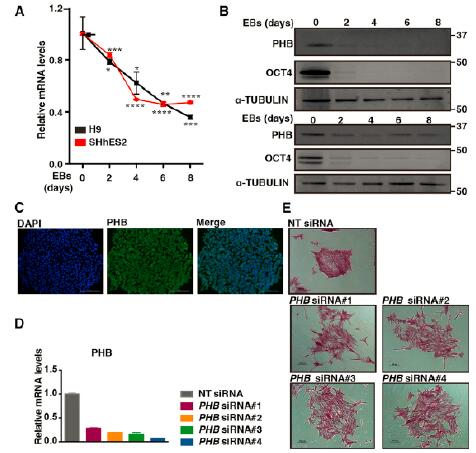
2.PHB对于hESC的自我更新维持以及人体细胞的重编程是必须的
研究者选择了高Z score,敲低后引起严重分化的PHB作为重点研究对象。PHB在未分化的hESC中高表达,并随着hESC的分化表达降低。为了研究PHB在全局范围的影响,研究者分析了PHB基因敲低后转录组的变化,发现有3009个基因差异表达显著(fold change > 2, p <0.05)。通过差异基因的GO分析发现功能富集在了染色质修饰功能上,因此研究者探索了PHB缺失是否能够改变组蛋白的修饰。研究发现,PHB缺失导致了组蛋白的高甲基化。随后还发现,在利用干细胞四因子诱导人成纤维细胞回复多能性时,PHB能够显著加速这一过程。
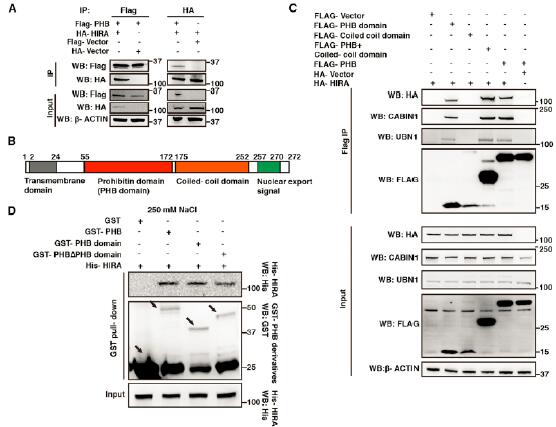
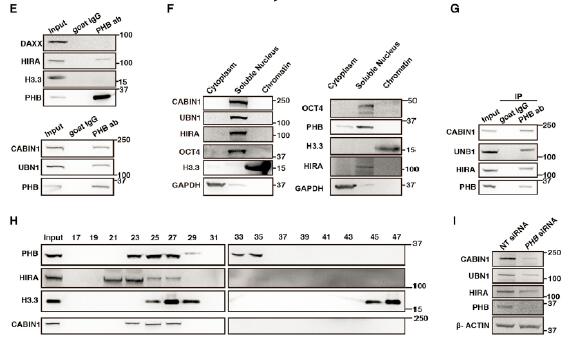
3.PHB与HIRA复合体相互作用
为了研究清楚PHB在hESC中如何发挥作用,研究者采用IP和MS的技术发现除了线粒体的一些相关蛋白外,HIRA也与PHB相互作用。进一步研究发现,PHB结构域介导了PHB与HIRA的结合。由于HIRA复合体的成员还有UBN1和CABIN1,研究者继续研究了PHB与它们的作用。研究发现PHB和HIRA共同调控H3.3在染色质上的富集。PHB敲低后同时影响了HIRA的三种组分的蛋白水平,对mRNA水平无影响。
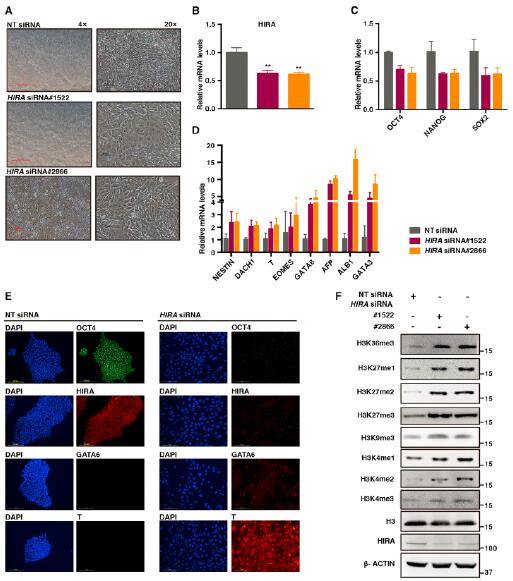
4.HIRA复合体在hESC中的作用与PHB相似
由于HIRA在hESC中的作用尚不清楚,研究者采用了siRNAs敲低HIRA的表达。研究结果发现,HIRA缺失的hESC出现了严重的分化并伴随着多能性维持核心因子的降低以及细胞系基因标记基因的表达上升。而且,HIRA缺失导致了组蛋白正常修饰的紊乱。
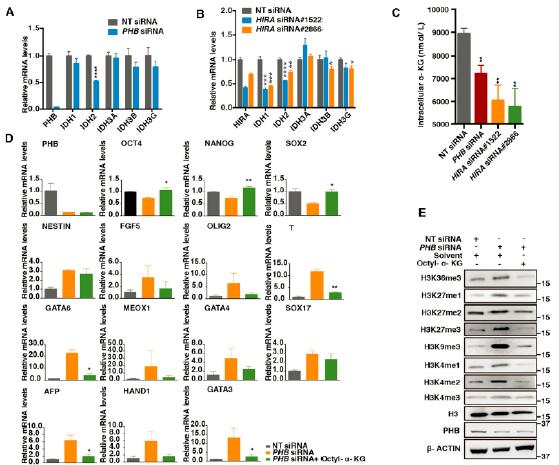
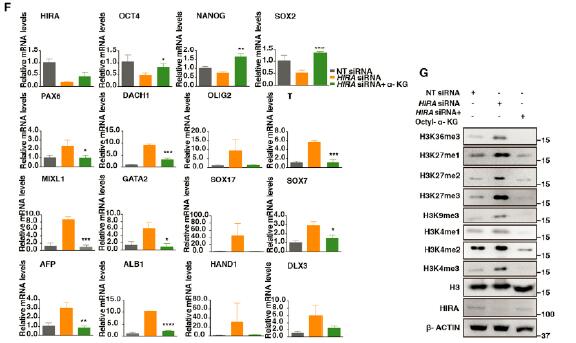
5.PHB与HIRA复合体共同作用控制着IDH的表达
研究者随后探究了PHB,HIRA对IDH-a-KG代谢通路的影响。研究发现,PHB,HIRA缺失导致了IDH表达显著减低,并伴随着细胞内α酮戊二酸的显著降低。而α酮戊二酸对于hESC干性的自我维持具有重要的作用。
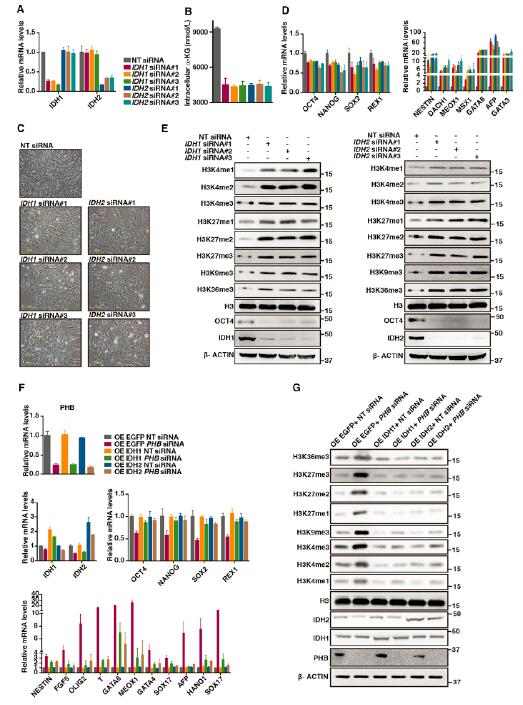
6.PHB和HIRA共同调控H3.3在染色质上的富集,特别是IDHs基因启动子区域的富集及IDH基因的表达
为了研究清楚PHB怎样在功能上与HIRA相关以及PHB与HIRA复合体如何调控α酮戊二酸的产量,研究者在上海伯豪生物技术有限公司做了H3.3的ChIP-seq研究。与input相比,H3.3主要富集在转录激活基因的TSS区和TES区。PHB和HIRA缺失均能导致H3.3全局性的沉积减少,进而导致了在IDH以及多能性维持基因启子区H3K4me3, RNAPIIS5P和RNAPII S2p富集的减少。PHB和HIRA缺失,导致在发育相关基因启动子区EZH2和H3K27me3富集减少,多能性维持基因启动子区增加。但对于IDH2基因,只有EZH2的富集增加。
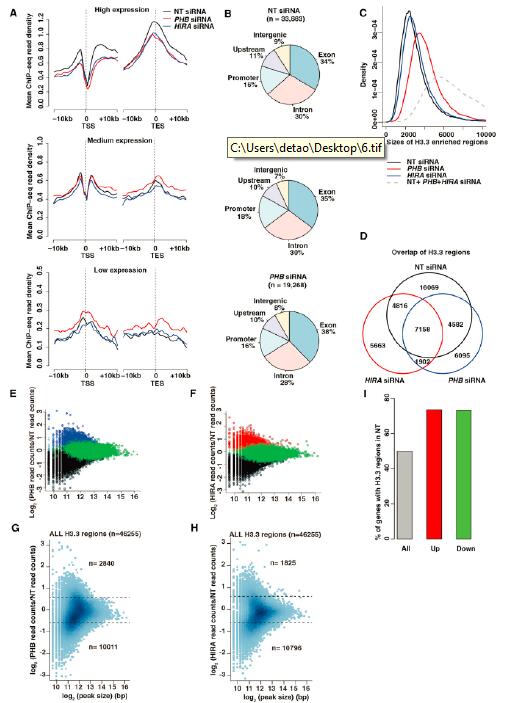
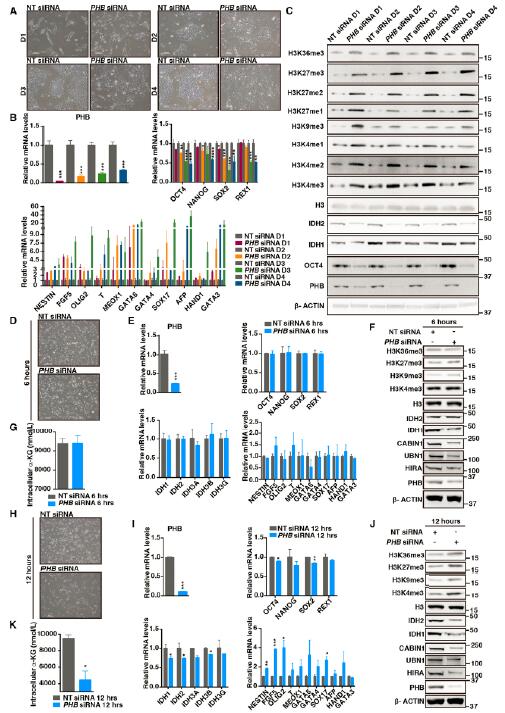
7.PHB缺失导致表观-代谢环路动态变化并改变hESC特性
本研究之前的所有关于PHB缺失后hESC形态的描述,都是发生在siRNA转染后第四天。为了确定这四天内的动态变化,研究者把这四天分成了四个阶段。第一天,细胞形态上并没有明显的变化,或只有轻微的变化,细胞系的标记基因也并没有检测到。但,组蛋白3各赖氨酸残基的甲基化水平已经发生显著增加,同时IDHs和OCT4的水平大幅减少。第二天,细胞形态学和细胞系标记基因的变化开始明显,并在第三天达到峰值,一直持续到第四天。研究者为了进一步弄清楚这一系列事件发生的顺序,评估了6h 和12h时的变化。PHB沉默6h后,只有HIRA复合体元件的表达量显著降低,其它均没有变化。在12 h, IDH1和IDH2以及α酮戊二酸显著降低,这一过程伴随着组蛋白赖氨酸甲基化修饰的增加。但在这一过程中,并没有细胞形态学以及细胞系标记基因的明显改变。
研究结论
研究者通过转录因子siRNA文库筛选,得到了25种对于维持hESC干性重要的转录因子,并选择PHB进一步研究。研究发现,PHB缺失后HIRA复合体成员表达降低,组蛋白赖氨酸残基甲基化修饰增加,随后IDH1和IDH2以及α酮戊二酸显著降低。这一表观-代谢通路的动态变化最终导致了hESC干性的丧失。原文出处
Zhu Z, Li C, Zeng Y, Ding J, Qu Z, Gu J, Ge L, Tang F, Huang X, Zhou C, Wang P, Zheng D, Jin Y. PHB Associates with the HIRA Complex to Control an Epigenetic-Metabolic Circuit in Human ESCs. Cell Stem Cell.2016(IF:22.387)
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发