那些年,小分子在肿瘤免疫治疗中的应用
| 导读 | 近期,总局发布了《总局关于发布过度重复药品提示信息的公告(2016年第153号)》一文,其中以“已获批准文号企业数多于20家且在销批准文号企业数超过20家为筛选条件”作为药品重复申报检索条件进行了目录发布。是否可以理解为超过20家销售则应该考虑是否值得介入,而在50家以上措辞就成为了“严重的过度重复问题”,并从“说明同一品种有10家企业生产销售即能基本满足市场需求”中可否推断总局的一些态度。而目前最火爆的免疫领域PD-1/L1靶点据报道已多于60家,为什么会出现这类现象呢,一方面肯定是疗效,而更多地个人认为可能就是钱途问题。 |
近期,总局发布了《总局关于发布过度重复药品提示信息的公告(2016年第153号)》一文,其中以“已获批准文号企业数多于20家且在销批准文号企业数超过20家为筛选条件”作为药品重复申报检索条件进行了目录发布。是否可以理解为超过20家销售则应该考虑是否值得介入,而在50家以上措辞就成为了“严重的过度重复问题”,并从“说明同一品种有10家企业生产销售即能基本满足市场需求”中可否推断总局的一些态度。而目前最火爆的免疫领域PD-1/L1靶点据报道已多于60家,为什么会出现这类现象呢,一方面肯定是疗效,而更多地个人认为可能就是钱途问题。
基础研究的进步,免疫疗法的发展正在为更多的患者带来福音,但也不可避免的付出高昂的治疗费用。在研的生物抗体药物,搭乘着Keytruda/Opdivo的快车,一路高歌猛进,耀眼曙目。Ipilimumab上市多年,抗体药物里程碑式发展也没有如此的引人瞩目,是靶点选择、是疗效、是技术、是科技进步亦或是全民网络的原因。在免疫疗法的轰炸下笔者也一度迷茫,随着学习,慢慢有些释怀,也有了更新的理解。前有Curis的小分子PD-L1/VISTA抑制剂IND,近有BET抑制剂小分子药物抑制PD-L1/PD-1通路的报道,更有针对免疫途径设计的众多小分子化合物,使笔者不禁在考虑是否目前上市的或者在研的许多小分子药物中,说不定也在激活或诱导着人体的免疫反应,或许只是我们还没有发现而已。
目前肿瘤免疫治疗策略似乎都是通过调节T细胞受体信号或使用天然的生物分子和相关肿瘤抗原的单克隆抗体刺激免疫系统的识别。小分子药物相对于生物免疫疗法具有许多的优点:小分子类药物的临床应用历史和发展,使患者更易接受和了解,具有较好的可行性;口服生物利用度;在肿瘤微环境等更大范围的应用可能性等;最显著的优点就是成本低、负担小,而且生产、运输、保存条件和技术要求低,并且患者用药方式方便(口服给药即可)。于是,小小检索了一下小分子有关免疫途径抑制剂或药物的文献报道,特将其中一篇拿来与大家分享。
小分子干预靶点简介
研究表明,一些肿瘤试剂(例如,阿霉素和环磷酰胺)能够激发有效抗原的表达和通过免疫原性细胞的死亡引发免疫反应促使肿瘤细胞死亡。其它细胞毒性剂(例如,紫杉烷类)能够阻止肿瘤增殖并在肿瘤微环境中影响先天免疫细胞的功能。同样,具有抑制肿瘤细胞(例如,BRAFV600)和免疫系统细胞的靶点激酶抑制剂,能够阻断肿瘤增殖和免疫刺激的脱靶作用。基于对药物的免疫调节性质的新认识,已经开始研究易普利姆玛与紫杉醇和卡铂连用作为非小细胞肺癌治疗的应用,以及与vemurafenib连用在黑色素瘤治疗中的应用,以确定这些小分子药物是否能积极地影响免疫应答和获得临床协同效应。
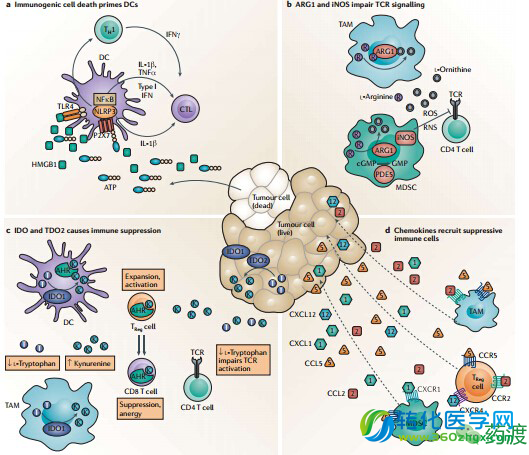
在许多情况下,由小分子药物靶向的胞内机制是不能由单抗靶向和调节的免疫细胞类型,也不能直接通过检查点阻断。有两个领域研究发展较好:包括MDSC的调节、树突状细胞和由吲哚胺2,3-双加氧酶1 (IDO1)、精氨酸酶1 (ARG1)诱导型一氧化氮合成酶(iNOS)或5型磷酸二酯酶(PDE5)调节的TAM,以及受控于ATP,CD39和CD73,腺苷和升高的环AMP淋巴细胞中的嘌呤信号通路。
氨基酸的分解代谢途径
氨基酸的代谢是一种进化上的保守途径,具有调节生理学上所需的氨基酸水平的作用。随着时间的推移,在高等生物中这些过程又赋予了新的作用,比如对病原微生物和哺乳动物宿主营养的争夺和先天免疫反应的调节。已阐明在半胱氨酸,谷氨酸,苯丙氨酸,色氨酸和精氨酸代谢作用中对癌症的免疫调节反应,尤其是T细胞增殖和活化的作用。
IDO家族包括三种酶:色氨酸2,3-双加氧酶(TDO),以及两个相关的IDO同工酶(IDO1,IDO2,统称为IDO)。TDO通常只在肝脏中表达,其主要作用是保持正常的色氨酸平衡;IDO则广泛存在,并在抗原提呈细胞(巨噬细胞和树突状细胞)中高度表达,IDO在多种肿瘤中也会表达失调并和预后不良有关。多种免疫抑制机制也是由于IDO的激活,包括Treg细胞的分化和过渡激活、T细胞免疫反应的抑制和树突状细胞功能下降,所有的这些都影响了免疫识别并促进肿瘤生长。目前的共识是:无论色氨酸的消耗还是其代谢物引发的信号传导都是免疫抑制的重要因素。小分子IDO抑制剂作为治疗用药的策略就是重建对癌症的免疫原性反应,而1-甲基色氨酸的D构型异构体是首个进入临床试验的IDO抑制剂,不过Incyte公司的IDO抑制剂是目前临床进展最快的。类似于IDO,TDO2抑制剂同样能够逆转高度表的TDO2的多种肿瘤细胞的免疫抗性。
Arginase.
L-精氨酸经ARG1和iNOS的分解代谢抑制了免疫力。ARG1是一种在肝脏表达的胞内酶,相关亚型ARG2则存在于不同细胞的线粒体中,MDSCs 和TAMs高度表达和分泌ARG1。在微环境,胞外精氨酸导致的TCR CD3链耗尽,因此抑制了T细胞对抗原的应答。T细胞受体的这种失活是由于控制转录和翻译的应激反应激酶GCN2(也称为EIF2AK4)耦合了细胞生长所需的氨基酸,这也是一种消耗精氨酸和色氨酸的共同途径。研究表明:抑制ARG1阻断了小鼠的肺癌生长。
迄今为止,N-hydroxy-nor-l-arginine和其他有望推进到临床的精氨酸类似物成为研究精氨酸酶抑制和心血管适应症的活性先导。其中对ARG1和ARG2最有效的化合物 IC50约0.5 μM并具有较好的生物利用度。此外,首个报道的抑制ARG1和iNOSd小分子药物是一种能够抑制环氧合酶并释放一氧化氮的硝基阿司匹林(NCX-4016)。
免疫细胞中的嘌呤信号
感染、组织损伤、缺血或干预引起的肿瘤细胞死亡能够造成局部胞外ATP水平急剧升高,升高的胞外ATP水平能够刺激免疫系统启动多个促炎性事件,包括巨噬细胞和树突细胞的聚集,激活树突细胞中NLRP3并释放IL-1β。胞外核苷酸酶CD39和CD73对胞外的ATP连续处理,使胞外腺苷含量从一个较低的自我平衡状态(20-200nm)迅速提升到高达1000-10,000nm的水平。这些高浓度的腺苷含量引起浸润淋巴细胞A2A和 A2B的免疫制疫活力,避免了细胞的过度炎症应答,从而提供了一个消退免疫反应的自我限制机制。在一个实体肿瘤的环境中,组织缺氧已被证明能够增加与正常水平相比10 - 20倍的腺苷水平。已经证明:腺苷升高能够保持一个慢性的先天免疫反应表达,导致免疫耐受,随即导致恶性增长不受控制。
细胞外腺苷信号可以通过促进核苷转运蛋白1 (ENT1)和ENT2以及通过脱氨基作用使腺苷转化为肌苷的腺苷脱氨酶的高度表达而终止。作为编码CD73基因启动子和CD39转录因子Sp1调控通路响应识别缺氧诱导因子1α (HIF1α),提供了一个直接的缺氧机制和腺苷水平升高之间的联系。Treg细胞中CD39和CD73的表达,使促炎性细胞外的ATP转化为能够结合T细胞受体A2A的免疫抑制腺苷,从而沉默抗肿瘤免疫反应。CD39在内皮细胞和白细胞的亚群,特别是在B细胞的表面表达。相对于肿瘤的免疫耐受,也有证据表明CD39升高增加了免疫抑制。ARL67176和核苷类似物8-丁巯基-ATP具有边缘选择性和效力,虽然他们已被用于在体内实验中,但这些化合物的药代动力学仍是未知。腺苷5?-(α,β亚甲基)二磷酸(ampcp)与其他所有的文献报道小分子CD73抑制剂,具有有效性和选择性,已被广泛用于体外研究以确认具有抑制肿瘤免疫反应的CD73催化活性。
COX-2和PGE2受体
在结肠直肠癌,环氧合酶(COX2)的诱导表达与低存活率相关,COX2也过表达在患有炎症性肠病结肠上皮细胞。COX2的主要代谢物PGE2除了刺激肿瘤细胞的增殖、存活和迁移,对免疫介导肿瘤逃逸也有直接的影响。PGE2是典型的炎症体征的主要介质:水肿、发红、肿胀和疼痛。PGE 2利于促炎(Th1型)免疫应答,但持续的水平,能够增强多种免疫抑制细胞(TAMs,TReg cells and MDSCs.)的活性。
cAMP是腺苷受体(A2A和A2B)和淋巴细胞PGE2受体(EP2 andep4)的第二信使,如前所述,在Treg细胞中腺苷和PGE 2升高cAMP的水平,从而增强抑制活性。它们对细胞活性的抑制影响可通过选择性拮抗剂(A2和EP2)进行抑制,并且这些拮抗剂的效果具有加和性。
Toll样受体
toll样受体(TLR)表达在在抗原提呈细胞如单核细胞和巨噬细胞、B细胞、中性粒细胞和树突细胞;以及暴露于外部环境的组织,如胃肠道和肺。所有的TLRs都属于1型跨膜蛋白,并且除了表达在核内体隔室的TLR3,7,8和9,其余均表达于胞浆内。TLR1和TLR2在巨噬细胞和中性粒细胞中表达,并识别革兰氏阳性细菌和真菌的分子模式,虽然已提出TLR2同源二聚体和TLR1-TLR2异源二聚体均存在,但只有异源二聚体经观察和实验实践被反复证实;TLR3识别双链RNA和聚肌苷(部分病毒的胞苷酸(PolyI:C) ),而TLR4可识别细菌细胞壁脂多糖;TLR5结合细菌鞭毛蛋白;TLR6和TLR7识别单链RNA,合成小分子如咪唑并喹啉和核苷类似物;TLR9结合细菌中非甲基化CpG和病毒的DNA;当激活时,TLRs激发强烈的能够刺激免疫监视的促炎性细胞因子反应。目前,在癌症适应症的TLR激动剂临床试验中,激动剂已经作为疫苗佐剂或单药治疗在应用。大部分实验是测定了胞内TLRs受体激动剂(3.7.8.9),小分子杂环化合物,如咪唑并喹啉,是通过激动TLR7和TLR8核苷受体激动剂。TLR7和TLR8的抗肿瘤活性主要通过树突状细胞与自然杀伤细胞直接杀伤肿瘤细胞和表达Treg细胞来介导。TLR7和TLR8激动剂Imiquimod已批准为局部单药治疗基底细胞癌,小分子TLR7激动剂852A和TLR8激动剂VTX2337也在进行实体和血液系统恶性肿瘤单药治疗方式的实验。TLR9激动剂,如IMO-2055,CPG7909和MGN1703,诱导树突细胞1型IFN的分泌,促进细胞毒性细胞、自然杀伤细胞和T细胞的TH1型反应,以及促进M2到M1的开关。所有这些作用有助于肿瘤特异性免疫反应和免疫抑制的逆转。
信号转导
细胞内的信号转导通路已被证明是小分子肿瘤靶向治疗发展的成功的干预措施。
细胞因子信号 JAK–STAT通路,介导多个细胞因子受体(例如,IL-2,IL-6和IFN-γ)信号,是吸引较多开发治疗自身免疫性疾病和癌症药物的领域。TGFβ,一个重要的性质就是肿瘤微环境中最有效的免疫抑制因子,通过结合TGF-β2型受体和信号通过ALK5(也被称为ββ受体1型)Smad2和samd3磷酸化来介导。小分子药物针对这些途径的开发进度一直缓慢,一个特异性问题就是JAK-STAT通路是一种广泛应用的细胞因子信号传导和TGF-β具有的正向或负向调节免疫反应。
肿瘤常过度表达细胞因子,如巨噬细胞集落刺激因子1(CSF1),以提供更有利的生长环境。只表达于髓系细胞的CSF1受体,通过磷酸化的酪氨酸激酶结构域被激活,激活后的CSF1促进髓性细胞瘤的增殖和肿瘤微环境中促进M1到M2的转化与TAM的积累。这些影响可以通过小分子CSF1抑制剂阻断,例如:plx3397和blz945。
致瘤激酶对免疫细胞的影响
伊马替尼和许多新的靶向肿瘤剂能抑制肿瘤生长和存活所需要的致癌激酶活性,这些直接的肿瘤靶向抑制剂也有直接的免疫调节作用。例如:对KIT癌基因抑制剂具有响应作用的胃肠道间质瘤,使用伊马替尼有效,令人惊讶的是,使用伊马替尼治疗的胃肠道间质患者无进展生存与外周自然杀伤细胞的IFN-γ增强相关,这就表明KIT癌基因的作用不仅限于是一种肿瘤生长因子。
类似于BCR-ABL驱动慢性粒细胞白血病, BRAFV660E突变也是高比例的存在于黑色素瘤患者中。BRAFV660E抑制剂(vemurafenib (Zelboraf;Roche), dabrafenib, MEK (trametinib)以及BRAF和MEK抑制剂的组合(dabrafenib和trametinib),已被批准用于治疗转移性黑色素瘤。临床研究表明,降低循环免疫细胞水平,在使用vemurafenib治疗黑色素瘤患者中减弱了由IL-1驱动的免疫抑制活性,增强了使用vemurafenib或dabrafenib和trametinib联合治疗转移性黑色素瘤患者的抗原递呈和Treg细胞CD8+浸润。
RON(也被称为巨噬细胞刺激蛋白受体)是一种在上皮细胞、破骨细胞和巨噬细胞上表达的受体酪氨酸激酶,活化的巨噬细胞刺激蛋白(MSP)促进细胞增殖、存活等。RON异常活化(通过RON过度表达蛋白或变异蛋白的表达)在不同类型的肿瘤中发现有助于肿瘤生长,血管生成和耐药性生成。RON的激活,也能阻断CD8 + T细胞的抗肿瘤反应。选择性RON激酶抑制剂BMS-777607已作为一种靶向肿瘤试剂进入临床。对携有PyMT肿瘤细胞的工程小鼠注射BMS-777607,抑制过量表达的MSP阻断了肺转移瘤的生长。
白细胞特异性激酶
组成性激活PI3K-AKT信号转导通路刺激细胞的生长和增殖,PI3Kα和PI3Kβ存在于大多数细胞类型中,但PI3Kδ和PI3Kγ的仅限在白细胞(B细胞、T细胞和骨髓系细胞)中表达。PI3Kδ选择性抑制剂GS-1101 (idelalisib:Zydelig)在某些B细胞恶性肿瘤中取得令人瞩目的应答率,其最近已被批准作为二线治疗慢性淋巴细胞性白血病。在乳腺癌同源4T1基因模型小鼠中,选择性PI3Kδ抑制剂(pi-3065)阻断了肿瘤的生长和转移。pi-3065免疫调节作用可能是由于对先天免疫系统细胞的直接作用,消弱了T reg细胞和MDSCs的免疫抑制作用。PI3Kγ在髓细胞的先天免疫反应中起着重要的作用,tg100-115和AS605240对培养的肿瘤细胞无直接影响,表明PI3Kγ依赖性肿瘤的生长依赖于不表达PI3Kγ的髓系细胞,而不直接影响不表达PI3Kγ的肿瘤。
 生物PD-L1/PD-1免疫疗法虽好,但请不要贪杯,外面的世界也精彩。
生物PD-L1/PD-1免疫疗法虽好,但请不要贪杯,外面的世界也精彩。
原文:Jerry L. Adams et al. Big opportunities for smallmolecules in immuno-oncology,pub- lished online 31 July 2015;doi:10.1038/nrd4596(转化医学网360zhyx.com)
基础研究的进步,免疫疗法的发展正在为更多的患者带来福音,但也不可避免的付出高昂的治疗费用。在研的生物抗体药物,搭乘着Keytruda/Opdivo的快车,一路高歌猛进,耀眼曙目。Ipilimumab上市多年,抗体药物里程碑式发展也没有如此的引人瞩目,是靶点选择、是疗效、是技术、是科技进步亦或是全民网络的原因。在免疫疗法的轰炸下笔者也一度迷茫,随着学习,慢慢有些释怀,也有了更新的理解。前有Curis的小分子PD-L1/VISTA抑制剂IND,近有BET抑制剂小分子药物抑制PD-L1/PD-1通路的报道,更有针对免疫途径设计的众多小分子化合物,使笔者不禁在考虑是否目前上市的或者在研的许多小分子药物中,说不定也在激活或诱导着人体的免疫反应,或许只是我们还没有发现而已。
目前肿瘤免疫治疗策略似乎都是通过调节T细胞受体信号或使用天然的生物分子和相关肿瘤抗原的单克隆抗体刺激免疫系统的识别。小分子药物相对于生物免疫疗法具有许多的优点:小分子类药物的临床应用历史和发展,使患者更易接受和了解,具有较好的可行性;口服生物利用度;在肿瘤微环境等更大范围的应用可能性等;最显著的优点就是成本低、负担小,而且生产、运输、保存条件和技术要求低,并且患者用药方式方便(口服给药即可)。于是,小小检索了一下小分子有关免疫途径抑制剂或药物的文献报道,特将其中一篇拿来与大家分享。
小分子干预靶点简介
研究表明,一些肿瘤试剂(例如,阿霉素和环磷酰胺)能够激发有效抗原的表达和通过免疫原性细胞的死亡引发免疫反应促使肿瘤细胞死亡。其它细胞毒性剂(例如,紫杉烷类)能够阻止肿瘤增殖并在肿瘤微环境中影响先天免疫细胞的功能。同样,具有抑制肿瘤细胞(例如,BRAFV600)和免疫系统细胞的靶点激酶抑制剂,能够阻断肿瘤增殖和免疫刺激的脱靶作用。基于对药物的免疫调节性质的新认识,已经开始研究易普利姆玛与紫杉醇和卡铂连用作为非小细胞肺癌治疗的应用,以及与vemurafenib连用在黑色素瘤治疗中的应用,以确定这些小分子药物是否能积极地影响免疫应答和获得临床协同效应。
在许多情况下,由小分子药物靶向的胞内机制是不能由单抗靶向和调节的免疫细胞类型,也不能直接通过检查点阻断。有两个领域研究发展较好:包括MDSC的调节、树突状细胞和由吲哚胺2,3-双加氧酶1 (IDO1)、精氨酸酶1 (ARG1)诱导型一氧化氮合成酶(iNOS)或5型磷酸二酯酶(PDE5)调节的TAM,以及受控于ATP,CD39和CD73,腺苷和升高的环AMP淋巴细胞中的嘌呤信号通路。

Fig. 1 Small-molecule drug targets to restore cancerimmunity in the tumour
氨基酸的代谢是一种进化上的保守途径,具有调节生理学上所需的氨基酸水平的作用。随着时间的推移,在高等生物中这些过程又赋予了新的作用,比如对病原微生物和哺乳动物宿主营养的争夺和先天免疫反应的调节。已阐明在半胱氨酸,谷氨酸,苯丙氨酸,色氨酸和精氨酸代谢作用中对癌症的免疫调节反应,尤其是T细胞增殖和活化的作用。
IDO家族包括三种酶:色氨酸2,3-双加氧酶(TDO),以及两个相关的IDO同工酶(IDO1,IDO2,统称为IDO)。TDO通常只在肝脏中表达,其主要作用是保持正常的色氨酸平衡;IDO则广泛存在,并在抗原提呈细胞(巨噬细胞和树突状细胞)中高度表达,IDO在多种肿瘤中也会表达失调并和预后不良有关。多种免疫抑制机制也是由于IDO的激活,包括Treg细胞的分化和过渡激活、T细胞免疫反应的抑制和树突状细胞功能下降,所有的这些都影响了免疫识别并促进肿瘤生长。目前的共识是:无论色氨酸的消耗还是其代谢物引发的信号传导都是免疫抑制的重要因素。小分子IDO抑制剂作为治疗用药的策略就是重建对癌症的免疫原性反应,而1-甲基色氨酸的D构型异构体是首个进入临床试验的IDO抑制剂,不过Incyte公司的IDO抑制剂是目前临床进展最快的。类似于IDO,TDO2抑制剂同样能够逆转高度表的TDO2的多种肿瘤细胞的免疫抗性。
Arginase.
L-精氨酸经ARG1和iNOS的分解代谢抑制了免疫力。ARG1是一种在肝脏表达的胞内酶,相关亚型ARG2则存在于不同细胞的线粒体中,MDSCs 和TAMs高度表达和分泌ARG1。在微环境,胞外精氨酸导致的TCR CD3链耗尽,因此抑制了T细胞对抗原的应答。T细胞受体的这种失活是由于控制转录和翻译的应激反应激酶GCN2(也称为EIF2AK4)耦合了细胞生长所需的氨基酸,这也是一种消耗精氨酸和色氨酸的共同途径。研究表明:抑制ARG1阻断了小鼠的肺癌生长。
迄今为止,N-hydroxy-nor-l-arginine和其他有望推进到临床的精氨酸类似物成为研究精氨酸酶抑制和心血管适应症的活性先导。其中对ARG1和ARG2最有效的化合物 IC50约0.5 μM并具有较好的生物利用度。此外,首个报道的抑制ARG1和iNOSd小分子药物是一种能够抑制环氧合酶并释放一氧化氮的硝基阿司匹林(NCX-4016)。
免疫细胞中的嘌呤信号
感染、组织损伤、缺血或干预引起的肿瘤细胞死亡能够造成局部胞外ATP水平急剧升高,升高的胞外ATP水平能够刺激免疫系统启动多个促炎性事件,包括巨噬细胞和树突细胞的聚集,激活树突细胞中NLRP3并释放IL-1β。胞外核苷酸酶CD39和CD73对胞外的ATP连续处理,使胞外腺苷含量从一个较低的自我平衡状态(20-200nm)迅速提升到高达1000-10,000nm的水平。这些高浓度的腺苷含量引起浸润淋巴细胞A2A和 A2B的免疫制疫活力,避免了细胞的过度炎症应答,从而提供了一个消退免疫反应的自我限制机制。在一个实体肿瘤的环境中,组织缺氧已被证明能够增加与正常水平相比10 - 20倍的腺苷水平。已经证明:腺苷升高能够保持一个慢性的先天免疫反应表达,导致免疫耐受,随即导致恶性增长不受控制。
细胞外腺苷信号可以通过促进核苷转运蛋白1 (ENT1)和ENT2以及通过脱氨基作用使腺苷转化为肌苷的腺苷脱氨酶的高度表达而终止。作为编码CD73基因启动子和CD39转录因子Sp1调控通路响应识别缺氧诱导因子1α (HIF1α),提供了一个直接的缺氧机制和腺苷水平升高之间的联系。Treg细胞中CD39和CD73的表达,使促炎性细胞外的ATP转化为能够结合T细胞受体A2A的免疫抑制腺苷,从而沉默抗肿瘤免疫反应。CD39在内皮细胞和白细胞的亚群,特别是在B细胞的表面表达。相对于肿瘤的免疫耐受,也有证据表明CD39升高增加了免疫抑制。ARL67176和核苷类似物8-丁巯基-ATP具有边缘选择性和效力,虽然他们已被用于在体内实验中,但这些化合物的药代动力学仍是未知。腺苷5?-(α,β亚甲基)二磷酸(ampcp)与其他所有的文献报道小分子CD73抑制剂,具有有效性和选择性,已被广泛用于体外研究以确认具有抑制肿瘤免疫反应的CD73催化活性。
COX-2和PGE2受体
在结肠直肠癌,环氧合酶(COX2)的诱导表达与低存活率相关,COX2也过表达在患有炎症性肠病结肠上皮细胞。COX2的主要代谢物PGE2除了刺激肿瘤细胞的增殖、存活和迁移,对免疫介导肿瘤逃逸也有直接的影响。PGE2是典型的炎症体征的主要介质:水肿、发红、肿胀和疼痛。PGE 2利于促炎(Th1型)免疫应答,但持续的水平,能够增强多种免疫抑制细胞(TAMs,TReg cells and MDSCs.)的活性。
cAMP是腺苷受体(A2A和A2B)和淋巴细胞PGE2受体(EP2 andep4)的第二信使,如前所述,在Treg细胞中腺苷和PGE 2升高cAMP的水平,从而增强抑制活性。它们对细胞活性的抑制影响可通过选择性拮抗剂(A2和EP2)进行抑制,并且这些拮抗剂的效果具有加和性。
Toll样受体
toll样受体(TLR)表达在在抗原提呈细胞如单核细胞和巨噬细胞、B细胞、中性粒细胞和树突细胞;以及暴露于外部环境的组织,如胃肠道和肺。所有的TLRs都属于1型跨膜蛋白,并且除了表达在核内体隔室的TLR3,7,8和9,其余均表达于胞浆内。TLR1和TLR2在巨噬细胞和中性粒细胞中表达,并识别革兰氏阳性细菌和真菌的分子模式,虽然已提出TLR2同源二聚体和TLR1-TLR2异源二聚体均存在,但只有异源二聚体经观察和实验实践被反复证实;TLR3识别双链RNA和聚肌苷(部分病毒的胞苷酸(PolyI:C) ),而TLR4可识别细菌细胞壁脂多糖;TLR5结合细菌鞭毛蛋白;TLR6和TLR7识别单链RNA,合成小分子如咪唑并喹啉和核苷类似物;TLR9结合细菌中非甲基化CpG和病毒的DNA;当激活时,TLRs激发强烈的能够刺激免疫监视的促炎性细胞因子反应。目前,在癌症适应症的TLR激动剂临床试验中,激动剂已经作为疫苗佐剂或单药治疗在应用。大部分实验是测定了胞内TLRs受体激动剂(3.7.8.9),小分子杂环化合物,如咪唑并喹啉,是通过激动TLR7和TLR8核苷受体激动剂。TLR7和TLR8的抗肿瘤活性主要通过树突状细胞与自然杀伤细胞直接杀伤肿瘤细胞和表达Treg细胞来介导。TLR7和TLR8激动剂Imiquimod已批准为局部单药治疗基底细胞癌,小分子TLR7激动剂852A和TLR8激动剂VTX2337也在进行实体和血液系统恶性肿瘤单药治疗方式的实验。TLR9激动剂,如IMO-2055,CPG7909和MGN1703,诱导树突细胞1型IFN的分泌,促进细胞毒性细胞、自然杀伤细胞和T细胞的TH1型反应,以及促进M2到M1的开关。所有这些作用有助于肿瘤特异性免疫反应和免疫抑制的逆转。
信号转导
细胞内的信号转导通路已被证明是小分子肿瘤靶向治疗发展的成功的干预措施。
细胞因子信号 JAK–STAT通路,介导多个细胞因子受体(例如,IL-2,IL-6和IFN-γ)信号,是吸引较多开发治疗自身免疫性疾病和癌症药物的领域。TGFβ,一个重要的性质就是肿瘤微环境中最有效的免疫抑制因子,通过结合TGF-β2型受体和信号通过ALK5(也被称为ββ受体1型)Smad2和samd3磷酸化来介导。小分子药物针对这些途径的开发进度一直缓慢,一个特异性问题就是JAK-STAT通路是一种广泛应用的细胞因子信号传导和TGF-β具有的正向或负向调节免疫反应。
肿瘤常过度表达细胞因子,如巨噬细胞集落刺激因子1(CSF1),以提供更有利的生长环境。只表达于髓系细胞的CSF1受体,通过磷酸化的酪氨酸激酶结构域被激活,激活后的CSF1促进髓性细胞瘤的增殖和肿瘤微环境中促进M1到M2的转化与TAM的积累。这些影响可以通过小分子CSF1抑制剂阻断,例如:plx3397和blz945。
致瘤激酶对免疫细胞的影响
伊马替尼和许多新的靶向肿瘤剂能抑制肿瘤生长和存活所需要的致癌激酶活性,这些直接的肿瘤靶向抑制剂也有直接的免疫调节作用。例如:对KIT癌基因抑制剂具有响应作用的胃肠道间质瘤,使用伊马替尼有效,令人惊讶的是,使用伊马替尼治疗的胃肠道间质患者无进展生存与外周自然杀伤细胞的IFN-γ增强相关,这就表明KIT癌基因的作用不仅限于是一种肿瘤生长因子。
类似于BCR-ABL驱动慢性粒细胞白血病, BRAFV660E突变也是高比例的存在于黑色素瘤患者中。BRAFV660E抑制剂(vemurafenib (Zelboraf;Roche), dabrafenib, MEK (trametinib)以及BRAF和MEK抑制剂的组合(dabrafenib和trametinib),已被批准用于治疗转移性黑色素瘤。临床研究表明,降低循环免疫细胞水平,在使用vemurafenib治疗黑色素瘤患者中减弱了由IL-1驱动的免疫抑制活性,增强了使用vemurafenib或dabrafenib和trametinib联合治疗转移性黑色素瘤患者的抗原递呈和Treg细胞CD8+浸润。
RON(也被称为巨噬细胞刺激蛋白受体)是一种在上皮细胞、破骨细胞和巨噬细胞上表达的受体酪氨酸激酶,活化的巨噬细胞刺激蛋白(MSP)促进细胞增殖、存活等。RON异常活化(通过RON过度表达蛋白或变异蛋白的表达)在不同类型的肿瘤中发现有助于肿瘤生长,血管生成和耐药性生成。RON的激活,也能阻断CD8 + T细胞的抗肿瘤反应。选择性RON激酶抑制剂BMS-777607已作为一种靶向肿瘤试剂进入临床。对携有PyMT肿瘤细胞的工程小鼠注射BMS-777607,抑制过量表达的MSP阻断了肺转移瘤的生长。
白细胞特异性激酶
组成性激活PI3K-AKT信号转导通路刺激细胞的生长和增殖,PI3Kα和PI3Kβ存在于大多数细胞类型中,但PI3Kδ和PI3Kγ的仅限在白细胞(B细胞、T细胞和骨髓系细胞)中表达。PI3Kδ选择性抑制剂GS-1101 (idelalisib:Zydelig)在某些B细胞恶性肿瘤中取得令人瞩目的应答率,其最近已被批准作为二线治疗慢性淋巴细胞性白血病。在乳腺癌同源4T1基因模型小鼠中,选择性PI3Kδ抑制剂(pi-3065)阻断了肿瘤的生长和转移。pi-3065免疫调节作用可能是由于对先天免疫系统细胞的直接作用,消弱了T reg细胞和MDSCs的免疫抑制作用。PI3Kγ在髓细胞的先天免疫反应中起着重要的作用,tg100-115和AS605240对培养的肿瘤细胞无直接影响,表明PI3Kγ依赖性肿瘤的生长依赖于不表达PI3Kγ的髓系细胞,而不直接影响不表达PI3Kγ的肿瘤。
Table 1 Part Immuno-oncology targets amendable tosmall-molecule medicines

原文:Jerry L. Adams et al. Big opportunities for smallmolecules in immuno-oncology,pub- lished online 31 July 2015;doi:10.1038/nrd4596(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发