CAR-T细胞免疫疗法研发现状
| 导读 | CAR-T细胞疗法在早期的临床试验中并没有表现出惊人的疗效,然而随着抗CD19 CAR-T细胞疗法在B细胞恶性肿瘤中显示出的巨大潜力,CAR-T产品一时间成了抗肿瘤领域的新星。 |
CAR-T(嵌合抗原受体T细胞)药物是一种有生命的药物,原理在于经嵌合抗原受体修饰的T细胞,可以特异性地识别肿瘤相关抗原,使效应T细胞的靶向性、杀伤活性和持久性均较常规应用的免疫细胞高,从而发挥抗癌作用。CAR-T细胞疗法在早期的临床试验中并没有表现出惊人的疗效,然而随着抗CD19 CAR-T细胞疗法在B细胞恶性肿瘤中显示出的巨大潜力,CAR-T产品一时间成了抗肿瘤领域的新星。笔者结合相关文献、报告对CAR-T疗法的概念、研发进展等信息进行简要介绍,更多内容请见2016年《全球药物创新快讯》第4期。
CAR的设计特征
嵌合抗原受体(CARs)是由一个胞外抗原识别域(通常是一个单链抗体,也可以是多肽或者其他蛋白质)和一个胞内信号域组成。CAR的胞外部分用来识别特异性的肿瘤抗原,随后胞内信号域会刺激T细胞增殖,并且通过细胞溶解和细胞因子释放来消除肿瘤细胞。
第一代CARs的胞内信号域是CD3ζ信号链(signal 1),这一代产品在临床试验中效果有限,可能由于移植T细胞的活化诱导细胞死亡(AICD)或者T细胞扩增的持续性不好所导致。第二代CARs相比第一代CARs增加了一个胞内共刺激信号域(signal 2)。在过去的5年里,对于第二代含有CD28或者4-1BB(CD137) 共刺激信号域的抗CD19 CAR-T,在治疗B淋巴细胞白血病的临床试验中都表现出优异的疗效,但是仍然需要寻找更好的共刺激信号分子,来解决第二代CAR-T产品作用不持久等问题。第三代CARs不仅包含CD3ζ信号域,还包括两个共刺激信号分子(图1),这些共刺激信号分子主要包括CD28、4 1BB以及OX40 (CD134)等,在临床前研究中发现第三代CAR-T细胞疗法效果要优于第二代产品,一项针对第二代CAR-T(CD3ζ/CD28)和第三代CAR-T(CD3ζ/4 1BB/CD28)治疗效果比较的临床试验(NCT01853631)目前正在招募病人阶段。

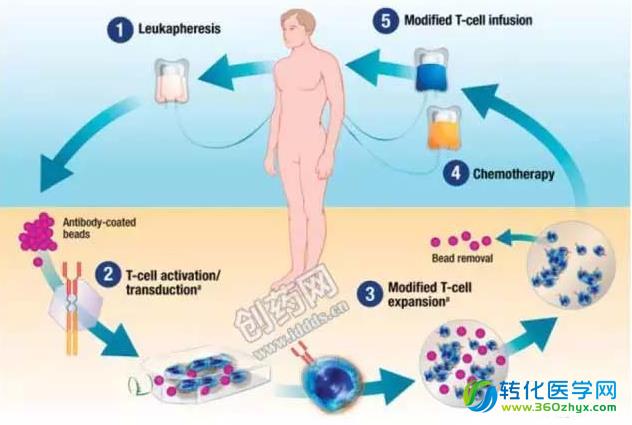
CAR-T细胞的生产和治疗主要有以下几个步骤:(1)白细胞分离:将病人的T细胞从外周血中分离出来;(2)T细胞活化:使用抗体包被的磁珠(人工树突状细胞)来激活T细胞;(3)转染:在体外对T细胞进行基因改造,使其表达嵌合抗原受体;(4)扩增:基因修饰过的T细胞在体外扩增;(5)化疗:在T细胞回输之前对病人进行化疗预处理;(6)回输:将基因修饰过的T细胞回输入病人体内(图2)。
由于目前CAR-T疗法在一些临床试验中显示出持久的疗效,很多分析师认为CAR-T细胞疗法可能在未来成为某些特定的复发性癌症的标准疗法,从而获得重磅炸弹级的销售额。这些期望主要源自于Juno和Kite这两家CAR-T研发领域的重要公司,凭借着丰富的CAR-T产品研发管线,这两家公司的市值已经达到数十亿美元,并且仍然保持着上升的势头。然而近期Juno公司CAR-T疗法JCAR015的二期临床试验却因病人死亡而被FDA叫停,这个二期临床试验(ROCKET)总共招募了20多位成人rrALL(难治性复发性急性白血病)患者,虽然产生了80%的应答,但先后出现三例脑水肿死亡事件,这无疑给原本有望在2017年上市的JCAR015带来负面影响,也使公众对CAR-T细胞疗法的安全性产生疑问,消息公布后Juno股票立刻暴跌30%,其主要竞争对手Kite股价也随之下跌10%。不过即便CAR-T产品的研发道路充满坎坷,后续的研发直至最终上市依然是指日可待。JCAR015被FDA短暂叫停之后,Juno公司对临床方案进行修改,并在FDA的批准下继续展开临床研究。
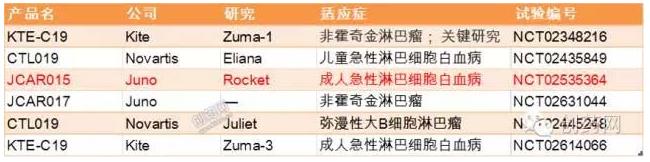
CAR-T目前还没有一个上市的产品,CAR-T研发公司一直不断地募集资金,并从学术机构获得授权许可,随后开展一系列小规模的临床试验,毫无疑问这些公司还处在烧钱阶段。谁将会成为第一个在美国市场上市销售的CAR-T产品仍然不得而知,除了刚刚出现问题的JCAR015,目前比较有希望获批的还有以下几个正在进行临床试验的药物,包括Kite的KTE-C19、诺华的CTL019以及Juno的JCAR017(表1)。
目前能与CD19表现出相似活性的靶点寥寥无几,稍微值得一提的是B细胞恶性肿瘤的CD22和多发性骨髓瘤的B细胞成熟抗原(BCMA),前者类似于CD19,而后者是一种表达于浆细胞的抗原。另外,解决实体瘤的问题就更加棘手,到目前为止几乎没有证据能证明CAR-T可以克服实体肿瘤中存在的众多问题而发挥作用,但是只要这是一个有潜力的市场,相关的研发和尝试就不会停止。
研发CAR-T产品对目前的公司来说,依然属于新兴的药物研发领域,在这种未知领域中,可能处处是暗礁,不断显现出来的障碍不容忽视。这些困难包括CAR-T产品复杂且昂贵的生产方式(据估计一个疗程大约需要50万美金)、CAR-T产品较差的持久性(肿瘤细胞可以通过很多途径对CAR-T疗法产生抵抗)以及一直存在的严重的毒性反应。并且从商业的角度来说,针对CD-19的CAR-T疗法在血液肿瘤领域的研发已经相当拥挤,迫使企业将研发转向实体瘤领域,但是目前来说实体肿瘤的免疫抑制微环境对CAR-T疗法来说是个极大的障碍。
为了减轻毒性反应,研发机构设计了新型CAR-T产品,通过降低剂量来提高安全性;生产厂家也在寻求大幅降低生产成本和生产时间的方法;克服癌症复发的新策略也在研发当中;mRNA电穿孔以及同种异体的CAR产品也在未来也将成为可能。
研发机构对改善CAR-T产品的功能还做出了很多别的尝试,包括人源化抗原结合区域、增加共刺激信号域。为了改善CAR-T对实体瘤的疗效,研究者也设计开发了新型的嵌合抗原受体(CARs),包括模块化CARs和抑制性CARs,以及可以另外释放细胞因子或者阻断免疫检查点的产品。这些有希望的研发进展吸引了大量资金的注入,领域内的合作和并购事件也屡见不鲜。但是投资者还是要提高警惕,类似Juno公司JCAR015的安全事件可能会放慢研发的脚步,但是对恶性事件的反思以及对研发空间的重新评估也有可能会带大更多的机会。
小结
目前,CAR-T细胞疗法在血液癌的治疗中已经取得惊人的效果,尤其是针对B细胞急性淋巴细胞白血病患者的初期缓解率可以达到90%左右。研究人员也在积极设计开发新型的CAR-T疗法,期望在其他血液肿瘤以及实体瘤种发挥类似疗效。寻找CD19以外的新型的有潜力的抗原靶标,减少毒副反应,克服肿瘤微环境中的免疫抑制作用是目前亟需解决的问题。文中所提到的一系列的针对实体瘤及其他血液肿瘤的正在进行中的临床试验,会给开发出更加安全以及有效的CAR-T疗法带来希望。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发