PD1CD28融合受体修饰CAR-T细胞可逆转肿瘤微环境的免疫抑制
| 导读 | PD-1是目前研究的最多的一个免疫抑制性受体,其表达在T细胞和前体B细胞表面,属于免疫球蛋白超家族的一员。 |
作者:健康骑兵 系复旦大学生物医学研究院2015级直博生

虽然嵌合抗原受体(CAR)修饰的过继转输T细胞治疗(ACT)在血液系统恶性肿瘤治疗中大放异彩,但在实体瘤的临床应用上却依然面临着诸多挑战。主要障碍之一为肿瘤的免疫抑制微环境,即通过上调抑制性受体来抑制肿瘤浸润性淋巴细胞(TIL)和基因工程化修饰T细胞的功能,特别是免疫抑制性受体PD-1的上调。
PD-1是目前研究的最多的一个免疫抑制性受体,其表达在T细胞和前体B细胞表面,属于免疫球蛋白超家族的一员。PD-L1(B7-H1,CD274)和PD-L2(B7-DC,CD273)是目前已发现的两个PD-1配体,研究发现PD-L1在多种肿瘤细胞膜表面的表达水平升高,肿瘤细胞巧妙地利用PD-L1去结合T细胞表面的PD-1受体来传递抑制性信号,从而导致免疫逃逸。多项临床前研究和临床试验均指出,采用PD-L1或PD-1阻断抗体来增强癌症患者的抗肿瘤免疫应答可作为一种新型的肿瘤免疫治疗手段,并且能够获得持续性的临床应答。此外,有研究提示, CAR-T细胞治疗联合抗PD-1抗体可以大大增强CAR-T细胞的抗肿瘤效应,那么在CAR-T细胞膜表面表达PD1CD28融合受体,即采用共刺激分子CD28的胞内激活信号域替换PD-1受体的胞内抑制信号域,是否可以逆转PD-L-PD-1的抑制信号,增强CAR-T细胞治疗的效用,甚至优于抗PD-1阻断抗体联用的治疗效果?2016年3月15日发表在Cancer Research上的一项研究成果恰好回答了该问题。Cancer Res: A Chimeric Switch-Receptor Targeting PD1 Augments the Efficacy of Second-Generation CAR T Cells in Advanced Solid Tumors
宾夕法尼亚大学的Edmund K. Moon和Yangbing Zhao领导的一项研究结果显示,PD1CD28融合受体可以增强二代CAR-T细胞在晚期实体瘤中的免疫应答效应。首先,研究者通过电转CD19Z CAR和PD1CD28的RNA至人的原代T细胞内瞬时表达,并证实了PD1CD28融合受体可大大增强CD19Z CAR-T细胞对CD19+PD-L1+靶细胞的杀伤活性(图1B)和增加细胞因子的分泌(图1C)。此外,研究者进一步探究了T细胞内源性PD-1的上调是否会影响PD1CD28融合受体的效用。研究结果显示,即使在PD-1过表达的情况下,电转了19Z/PD-1/PD1CD28 的修饰T细胞仍然能够产生大量的细胞因子,包括IL-2和IFN-γ(图1D)。
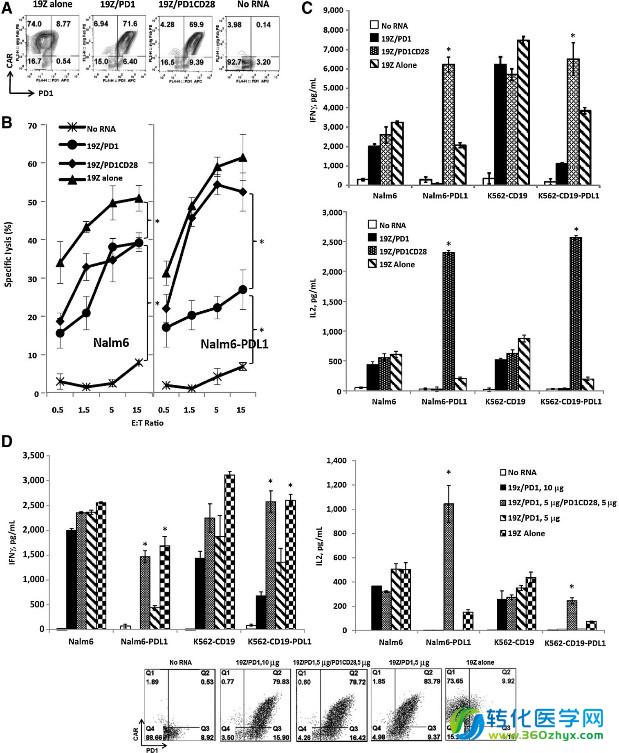 图1 19Z/PD1CD28 T细胞细胞因子分泌量增加
图1 19Z/PD1CD28 T细胞细胞因子分泌量增加
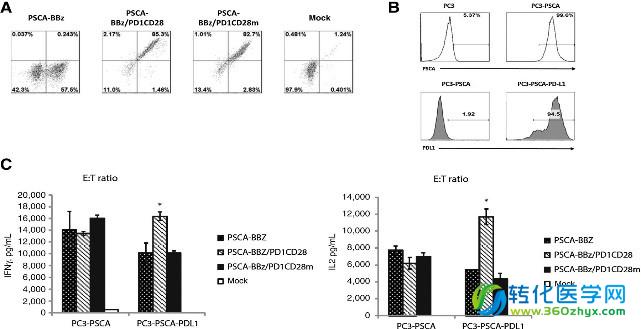
图2 PD1CD28增强细胞因子分泌依赖CD28信号域
接着,研究者采用逆转录病毒系统将PSCA-BBz CAR和PD1CD28转导至人的原代T细胞内,并证实CD28胞内信号域的存在是PSCA-BBz /PD1CD28-T细胞细胞因子分泌增强的关键因素。研究者发现,相对于PSCA-BBz CAR-T细胞而言,与PC3-PSCA-PD-L1靶细胞共培养的PSCA-BBz /PD1CD28-T能够产生更多的IL-2和IFN-γ,而突变体PD1CD28m产生细胞因子的能力与PSCA-BBz CAR-T细胞相近(图2C)。再者,慢病毒系统转导SS1 BBz CAR和PD1CD28至人的原代T细胞内同样可以增强修饰T细胞的杀伤效应以及增加细胞因子的分泌量。首先,研究者采用慢病毒系统转导抗间皮素CAR(SS1 BBz CAR)和PD1CD28至原代T细胞中,接着将SS1 BBz /PD1CD28-T细胞与间皮素EMMSO和PD-L1双阳性靶细胞共培养,同样发现SS1 BBz /PD1CD28-T细胞相对于SS1BBz CAR-T细胞可产生更多的IFN-γ(图3B)和IL-2(图3C),以及更强的杀伤肿瘤效应。即使当效靶比(E:T ratios)仅为1:1时,SS1BBz /PD1CD28-T细胞的杀伤效应仍有22%,而SS1BBZ CAR-T细胞已无杀伤作用,(图3D)。

然后,研究者在两种独立的荷瘤小鼠模型中评估PD1CD28的效能,分别是采用SS1 BBz CAR-T细胞治疗EMMSO间皮瘤模型和采用PSCA BBz CAR-T细胞治疗的PC3前列腺癌肿瘤模型。为了进一步探究PD1CD28的作用机制,研究者还研究了抗PD-1阻断抗体pembrolizumab和SS1 BBz CAR-T细胞联用的治疗效果,以及突变体PD1CD28m在PC3前列腺癌肿瘤模型中的抗肿瘤活性。研究结果显示,mock T细胞组和抗PD-1阻断抗体单用组的肿瘤生长速率相近,并且mock T细胞与抗PD-1阻断抗体联用组的肿瘤体积亦无显著性减小。然而,SS1 BBz CAR-T细胞治疗组的肿瘤体积显著减小,联用pembrolizumab可以进一步减缓肿瘤的生长。值得注意的是,SS1 BBz/PD1CD28 T细胞治疗组的抗肿瘤效应最强(SS1 BBz+Ab组的400 mm3 vs. SS1 BBz/PD1CD28组的147 mm3)(图4A)。上述研究结果表明,在小鼠荷瘤模型中证实了PD1CD28融合受体增强CAR-T细胞抗瘤活性的效果要优于抗PD-1阻断抗体的联用。紧接着,研究者进一步分析了荷瘤小鼠肿瘤组织的肿瘤浸润性淋巴细胞(TIL)的比例。以CD45为TIL标记物的研究结果表明,mock T细胞组和mock+Ab组肿瘤组织的TIL比例均低于1.5%,SS1 BBz组为46.8%,SS1 BBz+Ab组为58%,而SS1 BBz/PD1CD28组的TIL比例高达91.8%。同时为了避免肿瘤不同大小可能引起的假阳性结果,研究者使用TIL总细胞数来评估不同处理组肿瘤组织内CAR-T细胞的扩增水平,结果同样表明SS1 BBz/PD1CD28组的TIL细胞数目最多(图4B),提示PD1CD28融合受体可以提高CAR-T细胞的扩增水平。此外,研究者进一步证实SS1 BBz/PD1CD28治疗组中新鲜分离的TIL相比较于SS1 BBz组和SS1 BBz组+Ab联用组具有更强的肿瘤杀伤活性和细胞因子分泌能力,但弱于注射时冻存的对照SS1 BBz CAR-T细胞(图4C和图4D),提示PD1CD28可以使CAR TIL保有更强的肿瘤杀伤活性和细胞因子分泌能力。
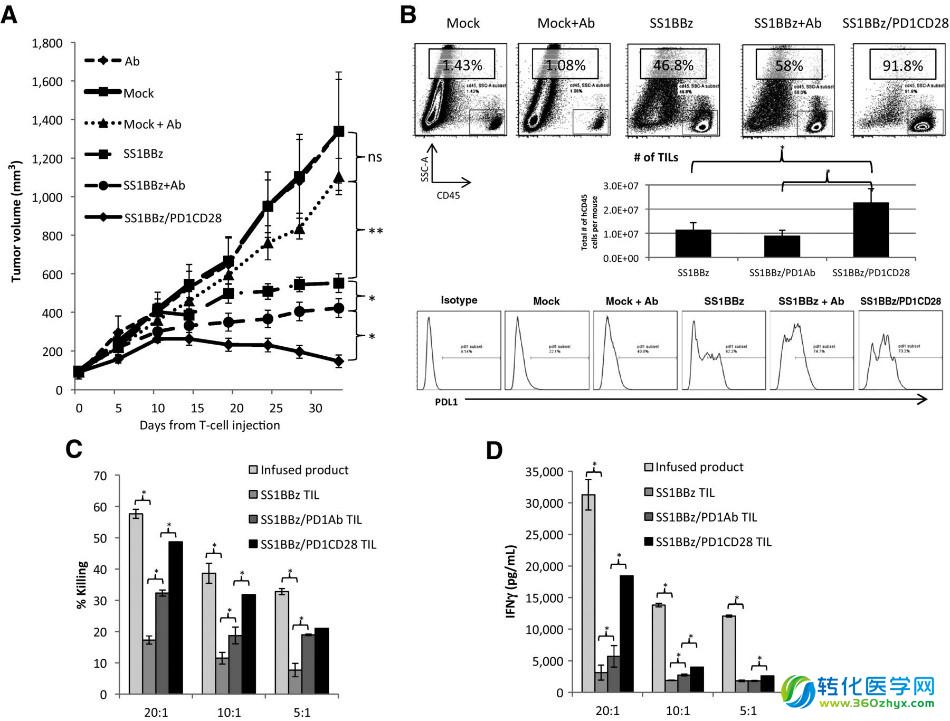
与输注T细胞相比较,研究者发现SS1 BBz组的CAR TIL的检查点分子PD-1和LAG3显著上调。SS1 BBz组的PD1+CD8+T细胞的比例从0.06%增加到41%,LAG3+CD8+T细胞的比例从26%增加到60%;SS1 BBz+Ab组检几乎测不到PD-1的表达,可能是被体内的pembrolizumab完全封闭,LAG3+CD8+T细胞的比例则从60%降到46%;SS1 BBz/PD1CD28治疗组的TIL几乎都表达PD-1,提示PD1CD28修饰T细胞在肿瘤组织的富集,而LAG3+CD8+T细胞的比例则从60%降到20%。此外,SS1 BBz/PD1CD28治疗组CEACAM1+Tim3+T细胞的比例亦从36%降至25%。上述研究结果表明,PD1CD28融合受体可以抑制EMMSO-浸润TIL膜表面免疫抑制性受体的上调(图5)。

为了进一步确定上述研究发现的可靠性和适用性,研究者亦评估了PD1CD28融合受体在PC3前列腺癌肿瘤模型中的效能。静脉输注2×106个PSCA BBz±PD1CD28 CAR-T细胞或mock T细胞至荷瘤小鼠体内,并采用生物发光成像仪监测肿瘤的生长情况。PSCA BBz±PD1CD28 T细胞治疗组均具有抗肿瘤活性,但PSCA BBz/PD1CD28 T细胞治疗组具有持续性的抗肿瘤免疫应答,肿瘤植入后第70天的监测结果显示PSCA BBz CAR-T细胞治疗组的小部分肿瘤逃逸了PSCA BBz CAR-T细胞的杀伤(图5B)。类似EMMSO间皮瘤模型的研究发现,PSCA BBz/PD1CD28 T细胞治疗组具有更高水平的TIL,更强的杀伤活性以及更高的细胞因子分泌水平(图6C和图6D)。抽取肿瘤植入后第35天的荷瘤小鼠外周血,流式细胞仪分析结果显示,PSCA BBz/PD1CD28 T细胞治疗组具有更高水平的CD8+T细胞(图6E)。

图6 PD1CD28增强PSCA-BBz T细胞抗瘤活性
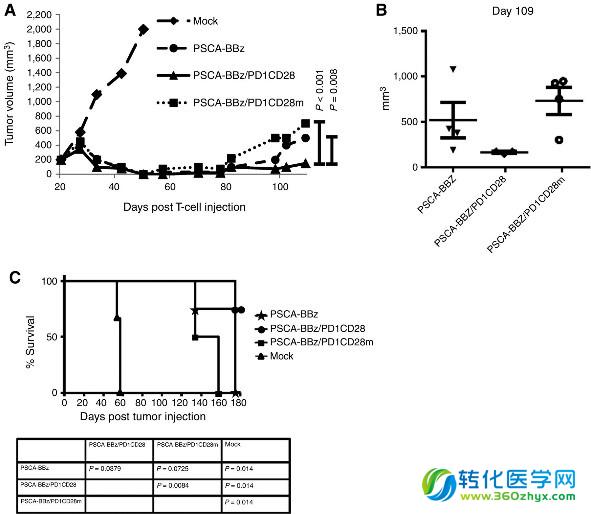
图7 PD1CD28增强的抗瘤活性依赖CD28信号域
前面体外实验已证实通过突变CD28信号域可阻断PD1CD28融合受体诱导的细胞因子产生,研究者们希望在前列腺癌荷瘤小鼠模型中进一步验证该研究发现。研究者往种植了PSCA-PC3-PD-L1前列腺癌细胞的荷瘤小鼠模型中静脉输注2×106个PSCA-BBz,PSCA-BBz/PD1CD28和PSCA-BBz/PD1CD28m T细胞,比较了各自的抗肿瘤效应。研究结果显示,所有CAR-T细胞都可以诱导肿瘤消退,但在CAR-T细胞输注80天后,PSCA-BBz T细胞治疗组的肿瘤开始反弹,且PSCA-BBz/PD1CD28m T细胞治疗组的反弹时间更早于PSCA-BBz T细胞治疗组,PSCA-BBz/PD1CD28 T细胞组无论是在肿瘤生长控制,还是在荷瘤小鼠生存率上均优于PSCA-BBz和PSCA-BBz/PD1CD28m T细胞治疗组(图7)。2015年7月23发表在J Natl Cancer Inst的一项研究成果-Impact of a New Fusion Receptor on PD-1-Mediated Immunosuppression in Adoptive T Cell Therapy同样揭示了PD1CD28融合受体可用于逆转过继转输T细胞治疗过程中出现的免疫抑制。在该项研究中,研究者构建了不同的PD1CD28融合受体,并通过逆转录病毒系统转导入OT-1转基因小鼠的CD8+T细胞,该转基因小鼠的CD8+T细胞可特异地识别抗原提呈细胞提呈的卵清蛋白抗原(OVA),研究者采用该系统来评估PD1CD28融合受体对T细胞增殖、细胞毒作用、细胞因子产生和肿瘤识别的影响.研究结果表明,PD1CD28融合受体发挥抗瘤效应依赖于CD28信号域和IFN-γ;PD1CD28融合受体修饰的小鼠CD8+T细胞可介导荷瘤小鼠肿瘤的完全消退,而这与肿瘤组织IFN-γ产生T细胞的聚集和肿瘤微环境内髓系来源抑制性细胞(MDSCs)的减少有关。
综上所述,PD1CD28融合受体修饰CAR-T细胞有望打破过继转输T细胞治疗中的PD-L-PD-1的免疫抑制信号轴,在实体瘤的细胞免疫治疗领域具有巨大的应用前景。(转化医学网360zhyx.com)本文是转化医学网原创内容,转载请点击获取授权
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发