BRCA2
| 导读 | 人乳腺癌易感基因2(breast cancer 2, early onset),其简写为BRCA2。BRCA2为具有遗传倾向的乳腺癌和卵巢癌的易感基因,在DNA损伤修复方面起着重要作用。
乳腺癌的发生发展是一系列基因、环境因素共同作用的结果。众多流行病学研究提示,月经、生殖、生活方式( 如初潮早、绝经晚、妊娠、堕胎、服用口服避孕药等) 等因素与乳腺癌的发生也密切相关,但不同基因背景的个体处于... |
人乳腺癌易感基因2(breast cancer 2, early onset),其简写为BRCA2。BRCA2为具有遗传倾向的乳腺癌和卵巢癌的易感基因,在DNA损伤修复方面起着重要作用。
乳腺癌的发生发展是一系列基因、环境因素共同作用的结果。众多流行病学研究提示,月经、生殖、生活方式( 如初潮早、绝经晚、妊娠、堕胎、服用口服避孕药等) 等因素与乳腺癌的发生也密切相关,但不同基因背景的个体处于同等暴露水平时对乳腺癌的易感性是不同的。这种基因背景的差异决定了个体患乳腺癌风险的大小。BRCA2是继BRCA1之后发现的家族性乳腺癌/卵巢癌易感基因,编码产物为一种肿瘤抑制因子。这种保护性蛋白通过同源重组及部分调节Rad51蛋白因子的活性参与双链DNA损伤的修复,从而阻止癌细胞的生长和发育。研究表明,突变的BRCA2基因可导致乳腺癌、卵巢癌和胰腺癌的发生风险升高。
基因结构
BRCA2基因位于第13号染色体13q12.3位置,全长84,193bp,其mRNA长11,386nt,共有27个外显子,编码3,418个氨基酸残基组成的蛋白质。
基因分子生物学功能
BRCA2是继BRCA1之后发现的家族性乳腺癌/卵巢癌易感基因。BRCA2在乳腺和甲状腺组织中高表达,在肺、卵巢和脾脏组织中表达水平低下。该基因mRNA长度约为BRCA1的2倍,由27个外显子组成,其中外显子11占全部编码序列的50%。研究表明,BRCA2与BRCA1蛋白在一个限制区域内(BRCA1的氨基酸1394-1474区和BRCA2的氨基酸1783-1863区)具有微弱的相似性。BRCA2基因突变在男性乳腺癌患者中多有出现,大大提高了男性乳腺癌的发生风险,约为6%。相反,携带BRCA1基因突变的男性却没有患乳腺癌的风险。无论男性还是女性,携带BRCA2基因突变的个体发生胰腺癌及另外一些肿瘤的风险都有所提高。
BRCA2和BRCA1一样具有保持基因组遗传稳定性的作用,是一种抑癌基因,但就目前的研究,其功能主要表现在通过同源重组机制修复双链断裂DNA上。
如图1,BRCA2蛋白是一个由3,418个氨基酸残基组成的与其它已知功能蛋白无明显序列同源性的机体保护性蛋白。BRCA2基因的第11个外显子编码8个BRC模序,该模序贯穿在BRCA2蛋白的中部,并且在哺乳动物的BRCA2蛋白中具有很强的保守性,提示该模序具有重要的生物学功能。每个BRC模序由70个氨基酸残基组成,其中26个残基为模序的核心序列。事实上,BRC模序是BRCA2蛋白与Rad51蛋白因子相互结合的位点。Rad51蛋白是细菌RecA蛋白和酵母ScRad51蛋白的一种同源蛋白,该蛋白对于哺乳动物DNA的修复及基因重组是必需的。因此,BRCA2蛋白与Rad51蛋白的相互结合在双链DNA的损伤修复中起着重要作用,它们共同定位于双链DNA链断裂处。
除BRC外,OB折叠(oligonucleotide/oligosaccharide-binding fold)和核定位信号(nuclear localization signal,NLS)也是BRCA2的重要组成部分。在绝大多数原核和真核生物的单链DNA(ssDNA)结合蛋白中都存在OB折叠。BRCA2有3个OB折叠。与OB1和OB3不同,OB2中插入了130个氨基酸残基的插入序列,构成塔式结构(tower domain),可以与双链DNA(dsDNA)结合。这样,BRCA2就既能与ssDNA结合,又能与dsDNA结合了。于是,Rad51通过与BRCA2的BRC模序相互作用,从而被BRCA2的OB折叠和塔式结构带到DNA的双链断裂处。此后, Rad51才开始对断裂的双链DNA进行同源重组修复。
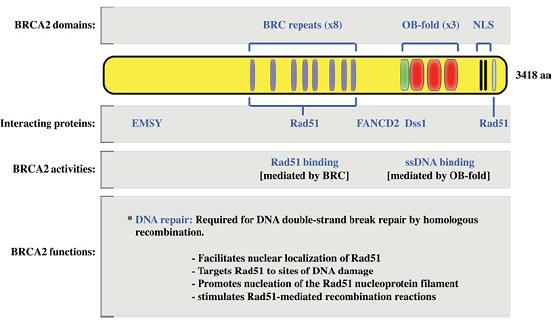
BRCA2的结构域、相互作用蛋白、活性及功能示意图
参与的通路
当DNA发生双链断裂后,在DNA双链损伤修复时,具有启动效应的基因——毛细血管扩张-共济失调突变基因(ataxia-telangiectasia-mutated,ATM)以BRCA1作为靶标,将后者磷酸化。经磷酸化激活的BRCA1结合到DNA断裂处,募集BRCA2携带着多种DNA修复因子向DNA断裂位置聚集,以同源DNA序列为参照,对损伤DNA进行同源重组修复(图2左边通路)。
另一方面,若BRCA1发生突变缺陷(图2右边通路),双链DNA不能得到修复,引起p53水平升高,继而p21升高,导致细胞凋亡和细胞周期停滞。如果是p53的基因修复失败,那么就会导致细胞增值。同理,如果是BRCA2发生突变缺陷,也应会造成类似结果。
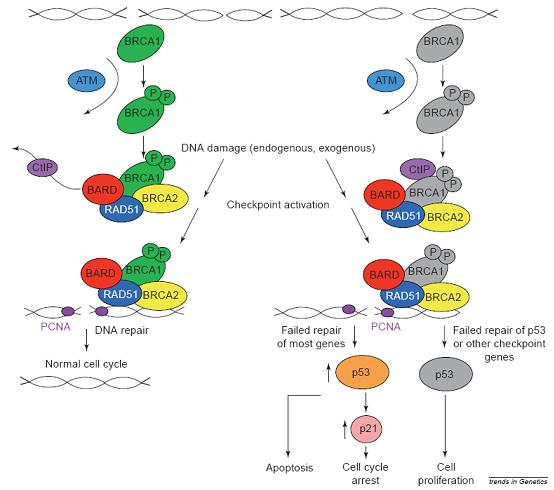
BRCA1和BRCA2介导的DNA双链断裂修复及BRCA1缺陷导致的细胞凋亡、细胞周期停滞和细胞增值
基因对疾病发生的影响
有研究认为,BRCA2基因的种系突变不但能大大增加乳腺癌的发病风险,而且可以增加卵巢癌的发病风险。BRCA2基因是一个乳腺与卵巢组织特异性肿瘤抑制基因,它符合Knudson的两次突变学说。在家族性乳腺癌中,BRCA2基因在生殖细胞中已经发生了一次突变(为种系突变),当乳腺组织再次发生突变时,形成杂合性缺失(loss of heterozygosity,LOH),导致癌症的发生。
对BRCA1和BRCA2的克隆和研究揭示,相当大比例家族遗传性乳腺癌和部分散发性乳腺癌的发生与这两个基因的突变有关。BRCA2与乳腺癌的关系密切,在一定程度上类似于BRCA1,但是BRCA2基因突变在男性乳腺癌的发生中也起着重要作用。BRCA1和BRCA2基因突变都有很高的外显性,能够对乳腺癌的发生进行比较准确的预测,尤其是具有乳腺癌家族史的个体。
基因功能的研究
1994年,Wooster等人[1]对患有多例早发性乳腺癌而又与BRCA1无关的15个家族进行基因组连锁分型分析,首先发现一个新的与早发性乳腺癌相关联的基因——BRCA 2,并定位于13号染色体长臂12-13区。次年,他们[2]又成功克隆了BRCA2基因。
研究发现Rad51、BRCA1和BRCA2同时出现在DNA断裂区段,这暗示它们可能共同参与了DNA的修复过程(图2)。
1997年,Scully等人[3]通过对MCF-7(乳腺癌细胞系)细胞的研究,发现在DNA损伤时,BRCA1发生磷酸化,且和Rad51一起参与基因修复。1998年,Chen等人[4]进一步证实了BRCA2也参与了DNA的双链断裂修复,即BRCA2与BRCA1和Rad51共同完成DNA的双链修复。
1997年,Wong等人[5]利用酵母双杂交技术和生化检测的方法,证实了BRCA2与Rad51相互作用是通过BRCA2基因11号外显子上8个重复结构——BRC模序来实现的。
同年,McAllister等人[6]确定了人类BRCA2基因的核定位信号(NLS),位于BRCA2蛋白的3263到3269位氨基酸残基上。
同年,Wang等人[7]以MCF-10F(正常乳腺表皮细胞系)和MCF-7为材料,研究了BRCA2在细胞周期中的表达变化。在两种细胞系中,BRCA2的RNA于G0和G1早期表达量低,于G1/S期时升高,而到S和G2/M期BRCA2表达量则持续保持较高水平。对于MCF-7细胞来说,当用紫杉醇药物阻断细胞周期时,BRCA2的转录水平出现降低。
同年,Suzuki等人[8]的研究发现BRCA2缺陷的小鼠胚胎在妊娠8.5到9.5天就死亡了。
同年,Connor等人[9]通过体外实验发现,取自BRCA2-/-小鼠的成纤维细胞不能增值生长,其原因可能是p53和p21的大量表达造成细胞凋亡和细胞周期中断。
1999年,Lee等人[10]通过小鼠实验,认为Bub1和p53等与细胞周期检测点相关基因的失活突变,在BRCA2基因缺陷导致遗传性乳腺癌的致病过程中起协同作用。一般,男性患乳腺癌的几率非常小,不过BRCA2突变却可以使得男性乳腺癌(male breast cancer,MBC)发生率增高。2001年,Thompson等人[11]对欧美164个BRCA2-BCLC家族(有59例MBC患者)的研究发现,到70岁时,携带BRCA2突变的男性患MBC的概率为2.8%(95%CI: 0.6-13.0%);到80岁时,概率增长到6.9%(95%CI: 1.2-38.6%)。这大约是一般男性患MBC的80倍。
2008年,Brown等人[12]发现在BRCA2缺陷的细胞中,射线辐射促使caspase 3降解Rad51。而当注入完整、有活性的人类BRCA2蛋白时,caspase 3降解Rad51的速率显著下降了。这说明,BRCA2能够抑制caspase 3对Rad51的降解作用。
乳腺癌的发生发展是一系列基因、环境因素共同作用的结果。众多流行病学研究提示,月经、生殖、生活方式( 如初潮早、绝经晚、妊娠、堕胎、服用口服避孕药等) 等因素与乳腺癌的发生也密切相关,但不同基因背景的个体处于同等暴露水平时对乳腺癌的易感性是不同的。这种基因背景的差异决定了个体患乳腺癌风险的大小。BRCA2是继BRCA1之后发现的家族性乳腺癌/卵巢癌易感基因,编码产物为一种肿瘤抑制因子。这种保护性蛋白通过同源重组及部分调节Rad51蛋白因子的活性参与双链DNA损伤的修复,从而阻止癌细胞的生长和发育。研究表明,突变的BRCA2基因可导致乳腺癌、卵巢癌和胰腺癌的发生风险升高。
基因结构
BRCA2基因位于第13号染色体13q12.3位置,全长84,193bp,其mRNA长11,386nt,共有27个外显子,编码3,418个氨基酸残基组成的蛋白质。
基因分子生物学功能
BRCA2是继BRCA1之后发现的家族性乳腺癌/卵巢癌易感基因。BRCA2在乳腺和甲状腺组织中高表达,在肺、卵巢和脾脏组织中表达水平低下。该基因mRNA长度约为BRCA1的2倍,由27个外显子组成,其中外显子11占全部编码序列的50%。研究表明,BRCA2与BRCA1蛋白在一个限制区域内(BRCA1的氨基酸1394-1474区和BRCA2的氨基酸1783-1863区)具有微弱的相似性。BRCA2基因突变在男性乳腺癌患者中多有出现,大大提高了男性乳腺癌的发生风险,约为6%。相反,携带BRCA1基因突变的男性却没有患乳腺癌的风险。无论男性还是女性,携带BRCA2基因突变的个体发生胰腺癌及另外一些肿瘤的风险都有所提高。
BRCA2和BRCA1一样具有保持基因组遗传稳定性的作用,是一种抑癌基因,但就目前的研究,其功能主要表现在通过同源重组机制修复双链断裂DNA上。
如图1,BRCA2蛋白是一个由3,418个氨基酸残基组成的与其它已知功能蛋白无明显序列同源性的机体保护性蛋白。BRCA2基因的第11个外显子编码8个BRC模序,该模序贯穿在BRCA2蛋白的中部,并且在哺乳动物的BRCA2蛋白中具有很强的保守性,提示该模序具有重要的生物学功能。每个BRC模序由70个氨基酸残基组成,其中26个残基为模序的核心序列。事实上,BRC模序是BRCA2蛋白与Rad51蛋白因子相互结合的位点。Rad51蛋白是细菌RecA蛋白和酵母ScRad51蛋白的一种同源蛋白,该蛋白对于哺乳动物DNA的修复及基因重组是必需的。因此,BRCA2蛋白与Rad51蛋白的相互结合在双链DNA的损伤修复中起着重要作用,它们共同定位于双链DNA链断裂处。
除BRC外,OB折叠(oligonucleotide/oligosaccharide-binding fold)和核定位信号(nuclear localization signal,NLS)也是BRCA2的重要组成部分。在绝大多数原核和真核生物的单链DNA(ssDNA)结合蛋白中都存在OB折叠。BRCA2有3个OB折叠。与OB1和OB3不同,OB2中插入了130个氨基酸残基的插入序列,构成塔式结构(tower domain),可以与双链DNA(dsDNA)结合。这样,BRCA2就既能与ssDNA结合,又能与dsDNA结合了。于是,Rad51通过与BRCA2的BRC模序相互作用,从而被BRCA2的OB折叠和塔式结构带到DNA的双链断裂处。此后, Rad51才开始对断裂的双链DNA进行同源重组修复。

BRCA2的结构域、相互作用蛋白、活性及功能示意图
参与的通路
当DNA发生双链断裂后,在DNA双链损伤修复时,具有启动效应的基因——毛细血管扩张-共济失调突变基因(ataxia-telangiectasia-mutated,ATM)以BRCA1作为靶标,将后者磷酸化。经磷酸化激活的BRCA1结合到DNA断裂处,募集BRCA2携带着多种DNA修复因子向DNA断裂位置聚集,以同源DNA序列为参照,对损伤DNA进行同源重组修复(图2左边通路)。
另一方面,若BRCA1发生突变缺陷(图2右边通路),双链DNA不能得到修复,引起p53水平升高,继而p21升高,导致细胞凋亡和细胞周期停滞。如果是p53的基因修复失败,那么就会导致细胞增值。同理,如果是BRCA2发生突变缺陷,也应会造成类似结果。

BRCA1和BRCA2介导的DNA双链断裂修复及BRCA1缺陷导致的细胞凋亡、细胞周期停滞和细胞增值
基因对疾病发生的影响
有研究认为,BRCA2基因的种系突变不但能大大增加乳腺癌的发病风险,而且可以增加卵巢癌的发病风险。BRCA2基因是一个乳腺与卵巢组织特异性肿瘤抑制基因,它符合Knudson的两次突变学说。在家族性乳腺癌中,BRCA2基因在生殖细胞中已经发生了一次突变(为种系突变),当乳腺组织再次发生突变时,形成杂合性缺失(loss of heterozygosity,LOH),导致癌症的发生。
对BRCA1和BRCA2的克隆和研究揭示,相当大比例家族遗传性乳腺癌和部分散发性乳腺癌的发生与这两个基因的突变有关。BRCA2与乳腺癌的关系密切,在一定程度上类似于BRCA1,但是BRCA2基因突变在男性乳腺癌的发生中也起着重要作用。BRCA1和BRCA2基因突变都有很高的外显性,能够对乳腺癌的发生进行比较准确的预测,尤其是具有乳腺癌家族史的个体。
基因功能的研究
1994年,Wooster等人[1]对患有多例早发性乳腺癌而又与BRCA1无关的15个家族进行基因组连锁分型分析,首先发现一个新的与早发性乳腺癌相关联的基因——BRCA 2,并定位于13号染色体长臂12-13区。次年,他们[2]又成功克隆了BRCA2基因。
研究发现Rad51、BRCA1和BRCA2同时出现在DNA断裂区段,这暗示它们可能共同参与了DNA的修复过程(图2)。
1997年,Scully等人[3]通过对MCF-7(乳腺癌细胞系)细胞的研究,发现在DNA损伤时,BRCA1发生磷酸化,且和Rad51一起参与基因修复。1998年,Chen等人[4]进一步证实了BRCA2也参与了DNA的双链断裂修复,即BRCA2与BRCA1和Rad51共同完成DNA的双链修复。
1997年,Wong等人[5]利用酵母双杂交技术和生化检测的方法,证实了BRCA2与Rad51相互作用是通过BRCA2基因11号外显子上8个重复结构——BRC模序来实现的。
同年,McAllister等人[6]确定了人类BRCA2基因的核定位信号(NLS),位于BRCA2蛋白的3263到3269位氨基酸残基上。
同年,Wang等人[7]以MCF-10F(正常乳腺表皮细胞系)和MCF-7为材料,研究了BRCA2在细胞周期中的表达变化。在两种细胞系中,BRCA2的RNA于G0和G1早期表达量低,于G1/S期时升高,而到S和G2/M期BRCA2表达量则持续保持较高水平。对于MCF-7细胞来说,当用紫杉醇药物阻断细胞周期时,BRCA2的转录水平出现降低。
同年,Suzuki等人[8]的研究发现BRCA2缺陷的小鼠胚胎在妊娠8.5到9.5天就死亡了。
同年,Connor等人[9]通过体外实验发现,取自BRCA2-/-小鼠的成纤维细胞不能增值生长,其原因可能是p53和p21的大量表达造成细胞凋亡和细胞周期中断。
1999年,Lee等人[10]通过小鼠实验,认为Bub1和p53等与细胞周期检测点相关基因的失活突变,在BRCA2基因缺陷导致遗传性乳腺癌的致病过程中起协同作用。一般,男性患乳腺癌的几率非常小,不过BRCA2突变却可以使得男性乳腺癌(male breast cancer,MBC)发生率增高。2001年,Thompson等人[11]对欧美164个BRCA2-BCLC家族(有59例MBC患者)的研究发现,到70岁时,携带BRCA2突变的男性患MBC的概率为2.8%(95%CI: 0.6-13.0%);到80岁时,概率增长到6.9%(95%CI: 1.2-38.6%)。这大约是一般男性患MBC的80倍。
2008年,Brown等人[12]发现在BRCA2缺陷的细胞中,射线辐射促使caspase 3降解Rad51。而当注入完整、有活性的人类BRCA2蛋白时,caspase 3降解Rad51的速率显著下降了。这说明,BRCA2能够抑制caspase 3对Rad51的降解作用。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发