CYP17A1
| 导读 | CYP17A1全称为cytochrome P450, family 17, subfamily A, polypeptide 1(细胞色素P450c17α),也被称为17α-羟化酶,17、20-裂解酶。细胞色素P450酶是一类催化药物代谢、胆固醇和类固醇合成的单加氧酶。CYP17A1是该酶家族成员之一,定位于细胞内质网及微粒体,在全身各组织器官都有表达,其中肝和肾表达量较多。CYP17A1同时具有... |
CYP17A1全称为cytochrome P450, family 17, subfamily A, polypeptide 1(细胞色素P450c17α),也被称为17α-羟化酶,17、20-裂解酶。细胞色素P450酶是一类催化药物代谢、胆固醇和类固醇合成的单加氧酶。CYP17A1是该酶家族成员之一,定位于细胞内质网及微粒体,在全身各组织器官都有表达,其中肝和肾表达量较多。CYP17A1同时具有17α-羟化酶、17,20-裂解酶的活性,在类固醇性激素合成的途径中起关键作用,能合成黄体酮、盐皮质激素、糖皮质激素、雄激素和雌激素。此基因的突变与类固醇-17α-羟化酶缺陷、17α-羟化酶/17,20-裂解酶缺陷、假两性畸形和肾上腺增生有关。
基因结构
CYP17A1位于第10号染色体10q24.3位置,全长7,003bp。CYP17A1基因共有8个外显子、7个内含子,mRNA总长1,895nt,编码508个氨基酸残基组成的蛋白质。
基因分子生物学功能
细胞色素P450(CYP450)是由许多同工酶组成的超大家族,是一类能催化胆固醇、类固醇及其他脂质合成和药物代谢等多种反应的单加氧酶,主要位于肝微粒体中,参与内源性(如类固醇激素、胆汁酸、脂肪酸、前列腺素等)和外源性化合物(药物、毒物、前致突变物、致癌物)的代谢,在调节机体与外界环境的相互作用以及保持机体内环境稳定中起重要作用。P450由三部分组成:血红素蛋白、黄素蛋白(NADPH细胞色素C还原酶)和磷脂(磷脂酰胆碱),其中血红素带有颜色,是细胞色素得名的由来。P450酶家族主要催化单加氧反应,作为I相代谢酶将底物转化为极性化合物,以提高其生物活性或易于被II相代谢酶解毒。同时,P450酶也通过此反应将胆固醇转化为各种类固醇激素,多个P450亚家族的同工酶共同参与了该通路,见下图。
CYP17A1是P450酶家族成员之一,定位于细胞内质网,在全身各组织器官都有表达,其中肝和肾表达量较多。CYP17A1同时具有17α-羟化酶、17,20-裂解酶的活性,前者给孕烯醇酮和孕酮添加羟基,后者为羟孕酮和羟基孕烯醇酸剥离类固醇核的侧链,这两步反应都是类固醇激素合成途径中的关键步骤。CYP17A1通过该途径能合成黄体酮、盐皮质激素、糖皮质激素、雄激素和雌激素,因此是此类激素合成代谢的关键因素之一。
由于CYP17A1参与性激素的生物合成,因此该基因多态性会直接影响性激素在体内的合成水平,从而影响其作用途径和作用效果。因此,有研究者提出假说,认为CYP17A1多态现象会提高机体内雄激素水平,从而间接促进了前列腺的生长,使得前列腺癌发生风险升高。此外,研究证实该基因的突变与类固醇-17α-羟化酶缺陷、17α-羟化酶/17,20-裂解酶缺陷、假两性畸形和肾上腺增生以及性激素失调的各类疾病有关。
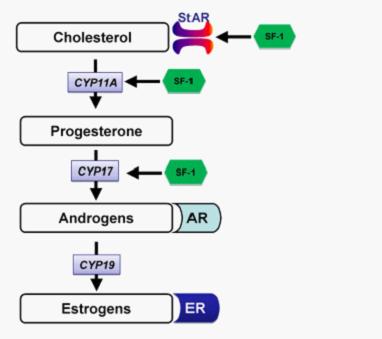
性激素生物合成通路
参与的通路
孕激素可作为合成睾丸激素的前体物质,CYP17A1催化这一转化反应,它可催化孕酮 17α-羟孕酮 雄烯二酮,或催化孕烯醇酮 17α-羟孕酮 DHEA(见下图)。该反应包括17α-羟化和C17-20裂解,它们是连续发生的。此后经数步反应,可生成雄烯二酮或睾丸激素。二者可经芳香酶转化为雌二醇或雌激素酮。该过程为性激素合成途径。
在类固醇激素合成途径中,CYP17作为关键酶控制着类固醇合成方向。在17α-羟化酶活性和17,20侧链裂解酶活性都不存在的情况下,孕烯醇酮则向合成盐皮质激素方向转化;如果只有17α-羟化酶活性发挥作用,孕烯醇酮向糖皮质激素方向转化;当17α-羟化酶和17,20侧链裂解酶同时具有活性时,孕烯醇酮可向性激素方向转化。有关调控17α-羟化酶/17,20侧链裂解酶活性比例的因素,目前倾向于认为与CYP17所在的的局部脂质膜组分电子传递有关[1]。也有人认为细胞因子如肿瘤坏死因子(TNF-α)、转化生长因子(TGF-β)可能以自分泌或旁分泌的方式参与调节。
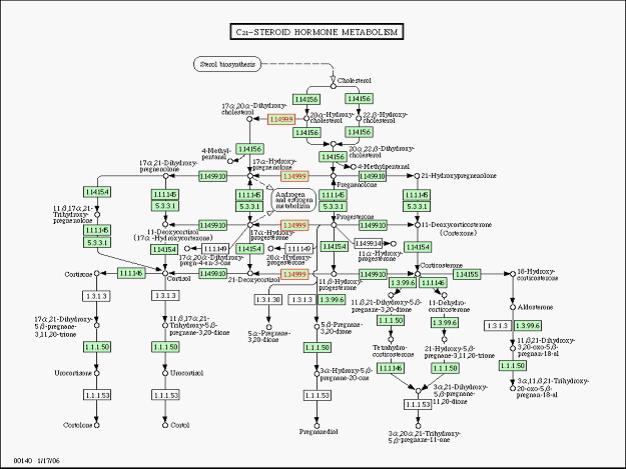
类固醇激素(雌激素、雄激素等)代谢示意图(红色方框内为CYP17A1)
基因对疾病发生的影响
当CYP17A1基因缺陷,表达量或活性下降时,会引起多种17α-羟化酶缺陷病,如先天性肾上腺增生(CAH)、性发育障碍等。
从世界上第一例17α-羟化酶缺陷有报道以来,全球已报道近130例,其中大部分患者是17α-羟化酶合并17,20-裂解酶活性缺乏。因CYP17A1在类固醇激素合成中起关键作用,若两种酶活性同时缺乏,孕烯醇酮向盐皮质激素方向转化,导致血中皮质醇、性激素水平降低,17α羟类固醇(17α羟孕酮,17α羟孕烯醇酮等)水平极低或测不出,而孕酮及孕烯醇酮水平升高。合并有17,20-侧链裂解酶缺陷时还伴有DHEA和雄烯二酮下降。促性腺激素及促肾上腺皮质激素(ACTH)呈高分泌状态,因而刺激肾上腺皮质增生和17-脱氧类固醇前体如孕酮、孕烯醇酮、脱氧皮质酮(DOC)、皮质酮等发挥盐皮质激素功能,出现高血压低血钾症群。另外,性激素分泌障碍引起性发育异常。17α羟化酶和17,20裂解酶活性缺乏时,在女性基因型患者呈原发性闭经,无青春期发育,无阴毛腋毛,无乳房发育;在男性基因型患者,尽管在胎儿睾丸中可产生正常的副中肾管抑制因子(MIF),从而使副中肾管退变,但睾丸不能分泌睾酮,同时缺乏男性性征,外生殖器呈女性化表现,有一阴道盲管,无副中肾管相应结构。
当CYP17A1发生突变,使得表达量增加或酶活性增强时,会引起性激素分泌过量,与性早熟、男性或女性特定肿瘤的发生有关。研究证实,CYP17A1是雌激素合成过程中的限速酶,高活性的17α-羟化酶和17,20-裂解酶可提高雌激素的合成水平。雌激素是增加子宫内膜癌患病的一个生化因素。因此,CYP17A1酶活性增强可导致子宫癌的发病风险升高。
基因功能研究
既往研究发现,17α羟化酶和17,20裂解酶是细胞色素P450c17α酶的两种同工酶,在人体性激素的合成中起非常重要的作用。20世纪80年代,研究人员将编码细胞色素P450c17α酶的基因命名为CYP17基因(CYP17A1),定位于10号染色体上[2],并利用克隆技术测出了其全长序列[3]。研究发现,P450酶基因家族的各个成员结构中有很多区域具有高度保守性,如P450c17和P450scc一样,其蛋白结构中都有一个亚铁血红素结合部位,该部位可能在决定底物特异性方面起重要作用。17α-羟化和C17-20裂解由该酶上同一位点催化[4],底物羟化的位置取决于和酶结合的类固醇的定向。另外,CYP17基因上有两个部分已被确定(氨基酸80-97及氨基酸296-319),它们在各物种间高度保守,可能和酶的催化活性有关[5]。现已确定,人、鼠、猪、豚鼠等体内编码P450c17的均为一个单一基因,该基因5’端有一550bp的高度同源区域,有一个相同的TATA盒[6]。
CYP17基因还可以发生多种形式的突变,此时其编码的细胞色素CYP17酶出现异常的结构和功能,使其介导的17α羟化酶和/或17,20裂解酶的活性下降或缺失,从而出现性激素分泌不足的表现[7]。
近年发现,在CYP17基因的5’启动子区碱基序列中存在着一个非常重要的多态位点,当出现A2等位基因时,理论上可以增加基因的转录效率,从而提高酶的活性,增加性激素的合成,一些研究发现,此时人群前列腺癌发生的危险性显著增加[8, 9]。
eigelson等人[10]首先研究了CYP17基因多态性对女性体内性激素水平的影响,发现随着A2等位基因出现频率的增加,即从A1/A2到A2/A2顺序,雌激素和孕酮有显著性的升高。
基因结构
CYP17A1位于第10号染色体10q24.3位置,全长7,003bp。CYP17A1基因共有8个外显子、7个内含子,mRNA总长1,895nt,编码508个氨基酸残基组成的蛋白质。
基因分子生物学功能
细胞色素P450(CYP450)是由许多同工酶组成的超大家族,是一类能催化胆固醇、类固醇及其他脂质合成和药物代谢等多种反应的单加氧酶,主要位于肝微粒体中,参与内源性(如类固醇激素、胆汁酸、脂肪酸、前列腺素等)和外源性化合物(药物、毒物、前致突变物、致癌物)的代谢,在调节机体与外界环境的相互作用以及保持机体内环境稳定中起重要作用。P450由三部分组成:血红素蛋白、黄素蛋白(NADPH细胞色素C还原酶)和磷脂(磷脂酰胆碱),其中血红素带有颜色,是细胞色素得名的由来。P450酶家族主要催化单加氧反应,作为I相代谢酶将底物转化为极性化合物,以提高其生物活性或易于被II相代谢酶解毒。同时,P450酶也通过此反应将胆固醇转化为各种类固醇激素,多个P450亚家族的同工酶共同参与了该通路,见下图。
CYP17A1是P450酶家族成员之一,定位于细胞内质网,在全身各组织器官都有表达,其中肝和肾表达量较多。CYP17A1同时具有17α-羟化酶、17,20-裂解酶的活性,前者给孕烯醇酮和孕酮添加羟基,后者为羟孕酮和羟基孕烯醇酸剥离类固醇核的侧链,这两步反应都是类固醇激素合成途径中的关键步骤。CYP17A1通过该途径能合成黄体酮、盐皮质激素、糖皮质激素、雄激素和雌激素,因此是此类激素合成代谢的关键因素之一。
由于CYP17A1参与性激素的生物合成,因此该基因多态性会直接影响性激素在体内的合成水平,从而影响其作用途径和作用效果。因此,有研究者提出假说,认为CYP17A1多态现象会提高机体内雄激素水平,从而间接促进了前列腺的生长,使得前列腺癌发生风险升高。此外,研究证实该基因的突变与类固醇-17α-羟化酶缺陷、17α-羟化酶/17,20-裂解酶缺陷、假两性畸形和肾上腺增生以及性激素失调的各类疾病有关。

性激素生物合成通路
参与的通路
孕激素可作为合成睾丸激素的前体物质,CYP17A1催化这一转化反应,它可催化孕酮 17α-羟孕酮 雄烯二酮,或催化孕烯醇酮 17α-羟孕酮 DHEA(见下图)。该反应包括17α-羟化和C17-20裂解,它们是连续发生的。此后经数步反应,可生成雄烯二酮或睾丸激素。二者可经芳香酶转化为雌二醇或雌激素酮。该过程为性激素合成途径。
在类固醇激素合成途径中,CYP17作为关键酶控制着类固醇合成方向。在17α-羟化酶活性和17,20侧链裂解酶活性都不存在的情况下,孕烯醇酮则向合成盐皮质激素方向转化;如果只有17α-羟化酶活性发挥作用,孕烯醇酮向糖皮质激素方向转化;当17α-羟化酶和17,20侧链裂解酶同时具有活性时,孕烯醇酮可向性激素方向转化。有关调控17α-羟化酶/17,20侧链裂解酶活性比例的因素,目前倾向于认为与CYP17所在的的局部脂质膜组分电子传递有关[1]。也有人认为细胞因子如肿瘤坏死因子(TNF-α)、转化生长因子(TGF-β)可能以自分泌或旁分泌的方式参与调节。

类固醇激素(雌激素、雄激素等)代谢示意图(红色方框内为CYP17A1)
基因对疾病发生的影响
当CYP17A1基因缺陷,表达量或活性下降时,会引起多种17α-羟化酶缺陷病,如先天性肾上腺增生(CAH)、性发育障碍等。
从世界上第一例17α-羟化酶缺陷有报道以来,全球已报道近130例,其中大部分患者是17α-羟化酶合并17,20-裂解酶活性缺乏。因CYP17A1在类固醇激素合成中起关键作用,若两种酶活性同时缺乏,孕烯醇酮向盐皮质激素方向转化,导致血中皮质醇、性激素水平降低,17α羟类固醇(17α羟孕酮,17α羟孕烯醇酮等)水平极低或测不出,而孕酮及孕烯醇酮水平升高。合并有17,20-侧链裂解酶缺陷时还伴有DHEA和雄烯二酮下降。促性腺激素及促肾上腺皮质激素(ACTH)呈高分泌状态,因而刺激肾上腺皮质增生和17-脱氧类固醇前体如孕酮、孕烯醇酮、脱氧皮质酮(DOC)、皮质酮等发挥盐皮质激素功能,出现高血压低血钾症群。另外,性激素分泌障碍引起性发育异常。17α羟化酶和17,20裂解酶活性缺乏时,在女性基因型患者呈原发性闭经,无青春期发育,无阴毛腋毛,无乳房发育;在男性基因型患者,尽管在胎儿睾丸中可产生正常的副中肾管抑制因子(MIF),从而使副中肾管退变,但睾丸不能分泌睾酮,同时缺乏男性性征,外生殖器呈女性化表现,有一阴道盲管,无副中肾管相应结构。
当CYP17A1发生突变,使得表达量增加或酶活性增强时,会引起性激素分泌过量,与性早熟、男性或女性特定肿瘤的发生有关。研究证实,CYP17A1是雌激素合成过程中的限速酶,高活性的17α-羟化酶和17,20-裂解酶可提高雌激素的合成水平。雌激素是增加子宫内膜癌患病的一个生化因素。因此,CYP17A1酶活性增强可导致子宫癌的发病风险升高。
基因功能研究
既往研究发现,17α羟化酶和17,20裂解酶是细胞色素P450c17α酶的两种同工酶,在人体性激素的合成中起非常重要的作用。20世纪80年代,研究人员将编码细胞色素P450c17α酶的基因命名为CYP17基因(CYP17A1),定位于10号染色体上[2],并利用克隆技术测出了其全长序列[3]。研究发现,P450酶基因家族的各个成员结构中有很多区域具有高度保守性,如P450c17和P450scc一样,其蛋白结构中都有一个亚铁血红素结合部位,该部位可能在决定底物特异性方面起重要作用。17α-羟化和C17-20裂解由该酶上同一位点催化[4],底物羟化的位置取决于和酶结合的类固醇的定向。另外,CYP17基因上有两个部分已被确定(氨基酸80-97及氨基酸296-319),它们在各物种间高度保守,可能和酶的催化活性有关[5]。现已确定,人、鼠、猪、豚鼠等体内编码P450c17的均为一个单一基因,该基因5’端有一550bp的高度同源区域,有一个相同的TATA盒[6]。
CYP17基因还可以发生多种形式的突变,此时其编码的细胞色素CYP17酶出现异常的结构和功能,使其介导的17α羟化酶和/或17,20裂解酶的活性下降或缺失,从而出现性激素分泌不足的表现[7]。
近年发现,在CYP17基因的5’启动子区碱基序列中存在着一个非常重要的多态位点,当出现A2等位基因时,理论上可以增加基因的转录效率,从而提高酶的活性,增加性激素的合成,一些研究发现,此时人群前列腺癌发生的危险性显著增加[8, 9]。
eigelson等人[10]首先研究了CYP17基因多态性对女性体内性激素水平的影响,发现随着A2等位基因出现频率的增加,即从A1/A2到A2/A2顺序,雌激素和孕酮有显著性的升高。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发