王守业:盘点2013年美国FDA批准的新药
| 导读 |
近日,药物研发领域著名期刊--Nature子刊Nature Review Drug Discovery对美国FDA在2013年批准的新药进行了盘点 (1)。本文就主要结合该报道,谈谈自己的一些看法。
2013年,美国FDA共批准27种新药(详细新药信息参见表一),其中25种为小分子化学药,只有两种为生物药。27... |

近日,药物研发领域著名期刊--Nature子刊Nature Review Drug Discovery对美国FDA在2013年批准的新药进行了盘点 (1)。本文就主要结合该报道,谈谈自己的一些看法。
2013年,美国FDA共批准27种新药(详细新药信息参见表一),其中25种为小分子化学药,只有两种为生物药。27种新药,这个数字相比于2012年批准的39种新药(该数字当年创下15年新高)大幅下挫了31%。但是和近5年或者近10年来美国FDA批准新药的平均数字相比,基本并无差异。2009年来平均每年美国有28种新药获批,2003年以来,这一数字则为26种(参见图1)。有意思的是,就在本周,Nature的另外一个子刊Nature Biotechnology也对2013年美国FDA批准的新药进行了类似的报道(2),但是,不同的是在这个报道中,FDA在2013年批准的新药数字为30种,其中24种为小分子化学药,6种为生物药。这数字不但FDA的官方数字相违背(3),也与上述Nature Review Drug Discovery的报道相悖,更与路透社在2013年年底的报道数字不同(4),经过我自己仔细检查、确认,Nature Biotechnology上述报道数字确实是错误的。这已经是我在不到两个星期的时间内第二次发现Nature Biotechnology上的硬伤性错误。这当然并不能说明Nature Biotechnology就是一个烂期刊,但是至少表明:不管是发表在多牛的期刊、杂志上的文章,都不要盲信,更不要盲目崇拜。
图1: FDA1993年以来批准的新药
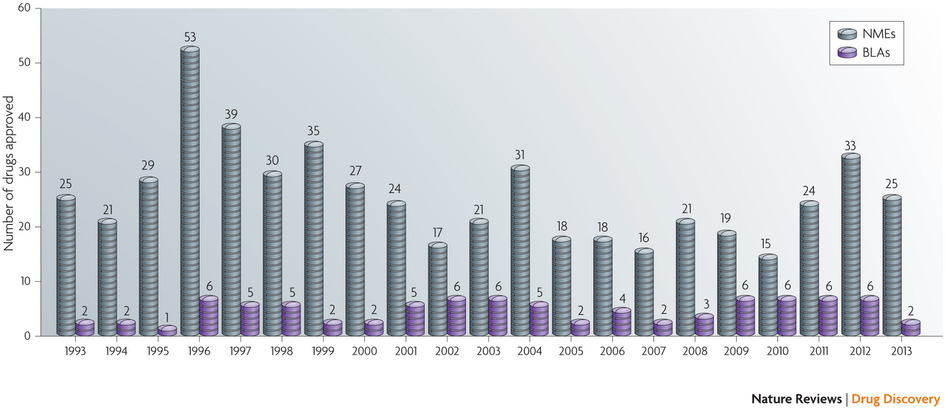
表1:2013年美国FDA批准的新药
Drug (brand) | Company | Properties | Indication | Review | |
Alogliptin (Nesina) | Takeda | DPP4 inhibitor | Type 2 diabetes | S | |
Mipomersen (Kynamro) | Genzyme | Oligonucleotide inhibitor of apolipoprotein B100 synthesis | Homozygous familial hypercholesterolaemia | S, O | |
Pomalidomide (Pomalyst) | Celgene | Immunomodulatory antineoplastic agent | Multiple myeloma | S, O | |
Ado-trastuzumab emtansine (Kadcyla)* | Genentech | HER2-targeted antibody and microtubule inhibitor conjugate | HER2-positive metastatic breast cancer | P | |
Ospemifene (Osphena) | Shionogi | Oestrogen receptor modulator | Moderate to severe dyspareunia due to menopause | S | |
Technetium TC 99m tilmanocept (Lymphoseek kit) | Navidea | Radioactive diagnostic agent | Lymphatic mapping in patients with breast cancer or melanoma | S | |
Gadoterate meglumine (Dotarem) | Guerbet | Gadolinium-based contrast agent | Contrast agent to visualize disruption of the blood–brain barrier | P | |
Dimethyl fumarate (Tecfidera) | Biogen Idec | MOA unknown; activates NRF2 pathway | Relapsing forms of multiple sclerosis | S | |
Canagliflozin (Invokana) | Janssen | SGLT2 inhibitor | Type 2 diabetes | S | |
Fluticasone; vilanterol (Breo Ellipta) | GSK | Corticosteroid plus LABA | Chronic obstructive pulmonary disease | S | |
Radium RA 223 dichloride (Xofigo) | Bayer | Alpha particle-emitting radioactive therapeutic | Castration-resistant prostate cancer | P | |
Dabrafenib (Tafinlar) | GSK | Kinase inhibitor with activity against BRAFV600E, BRAFV600K, BRAFV600D, wild-type BRAF and other kinases | Unresectable or metastatic melanoma with BRAFV600E mutation as detected by an FDA-approved test | S, O | |
Trametinib (Mekinist) | GSK | MEK1 and MEK2 kinase inhibitor | Unresectable or metastatic melanoma with BRAFV600E mutation as detected by an FDA-approved test | S, O | |
Afatinib (Gilotrif) | Boehringer Ingelheim | EGFR (ERBB1), HER2 (ERBB2), and HER4 (ERRB4) kinase inhibitor | First-line treatment of patients with metastatic NSCLC whose tumours have EGFR exon 19 deletions or exon 21 (L858R) substitution mutations as detected by an FDA-approved test | P, O | |
Dolutegravir (Tivicay) | ViiV | HIV1 integrase strand transfer inhibitor | HIV1 infection in adults and children, in combination with other antiretroviral agents | P | |
Vortioxetine (Brintellix) | Takeda | Serotonin reuptake inhibitor | Major depressive disorder | S | |
Bazedoxifene acetate plus oestrogens (Duavee) | Pfizer | Conjugated oestrogens with an oestrogen receptor modulator | Moderate to severe vasomotor symptoms associated with menopause and prevention of postmenopausal osteoporosis | S | |
Riociguat (Adempas) | Bayer | Soluble guanylyl cyclase stimulator | Persistent or recurrent chronic thromboembolic pulmonary hypertension and pulmonary arterial hypertension | P, O | |
Macitentan (Opsumit) | Actelion | Endothelin receptor antagonist | Pulmonary arterial hypertension | S, O | |
Flutemetamol F-18 (Vizamyl) | GE Healthcare | Radioactive diagnostic agent | PET imaging of the brain to estimate β-amyloid neuritic plaque density in patients who are being evaluated for Alzheimer's disease | S | |
Obinutuzumab (Gazyva)* | Genentech | Humanized CD20-specific monoclonal antibody | Previously untreated chronic lymphocytic leukaemia | P, O, B | |
Eslicarbazepine (Aptiom) | Sunovion | MOA unknown, but thought to involve voltage-gated sodium channels | Partial-onset seizures | S | |
Ibrutinib (Imbruvica) | Pharmacyclics | Bruton's tyrosine kinase inhibitor | Mantle cell lymphoma | P, O, B | |
Luliconazole (Luzu) | Medicis | Azole antifungal | Interdigital tinea pedis, tinea cruris and tinea corporis caused by Trichophyton rubrum and Epidermophyton floccosum | S | |
Simeprevir (Olysio) | Janssen | HCV NS3/4A protease inhibitor | Chronic HCV infection, as a component of a combination antiviral treatment regimen | P | |
Sofosbuvir (Sovaldi) | Gilead | HCV nucleotide analogue NS5B polymerase inhibitor | Chronic HCV infection, as a component of a combination antiviral treatment regimen | P, B | |
Umeclidinium and vilanterol (Anoro Ellipta) | GSK | Anticholinergic and a LABA | Chronic obstructive pulmonary disease | S | |
*Biologics license application. B, breakthrough designation status; CDER, Center for Drug Evaluation and Research; DPP4, dipeptidyl peptidase 4; EGFR, epidermal growth factor receptor; FDA, US Food and Drug Administration; GSK, GlaxoSmithKline; HCV, hepatitis C virus; LABA, long-acting β2-adrenergic receptor agonist; MEK, MAPK/ERK kinase; MOA, mechanism of action; NME, new molecular entity; NRF2, NFE2-related factor 2; NSCLC, non-small-cell lung cancer; O, orphan status; P, priority review; S, standard review. SGLT2, sodium-dependent glucose cotransporter 2 | |||||
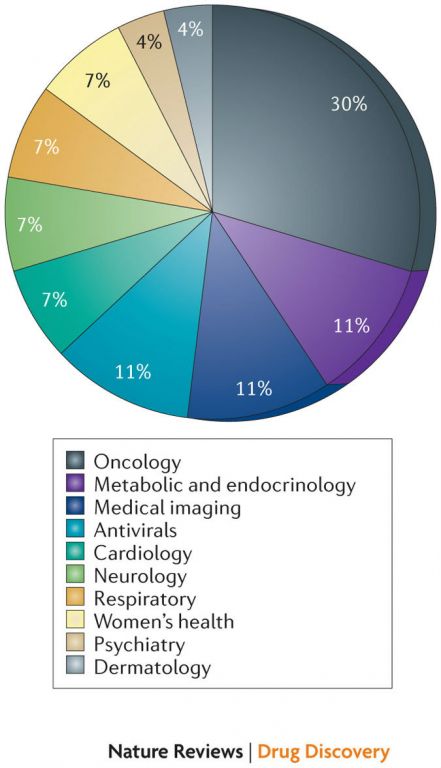
跑题回来,和过去几年类似,2013年批准的新药中孤儿药和抗癌药占比最大。2013年,美国FDA共批准9种孤儿药(对孤儿药感兴趣的科学网网友可参看文末提及的我的三篇有关孤儿药的博文),占总数的33%,真正地是“三分天下有其一”,上述比例,在2012年和2011年分别为33%和37%。2013年,美国FDA共批准8种抗癌药,占30%(参见图2),这个比例在2012年和2011年分别为33%和27%。在这8种抗癌药中,有6种为孤儿药,这也一定程度上反映了在孤儿药中,适应症为罕见的癌症亚型占比最大。其它占比较大的治疗领域还有代谢与内分泌,抗病毒(两种抗丙肝,一种抗HIV),医学成像产品(三种获批)(详见图2)。
图2: 2013年批准新药(根据治疗领域分类)
由于职业关系,我对生物药更感兴趣,但是有一种获批的化学药不得不提,它就是吉利德公司的Sofosbuvir(Sovaldi)。评价一种新药是否牛往往有三个标准: 1)科学上的新颖性;2)临床上的重要性;3)商业潜力。简单说就是结构是否新颖(或靶点是否新),临床上是否治了别的药治不好的病,对于药物公司而言,更重要的是最后一点:能否卖个好价钱。Sofosbuvir上述三点全部具备,是第一个NS5B聚合酶抑制剂新药,也是首个全口服丙肝药,对前两年Vertex获批的丙肝药的市场销售相信会产生较大冲击,该药的获批,也很可能意味着丙肝治疗的干扰素时代终将结束。据专业人士预测,该药在2018年全球销售额会达到68亿美元(参见表2),是2013年获批的27种新药中,市场前景最好的。正是由于这个未来的超级重磅药的获批,直接导致吉利德公司股票大幅上涨,2013年涨了近5倍,2013年底,公司股价突破了1000亿美元大关(5),甚至超过了独立生物公司丹麦的诺和诺德以及美国的安进,是全球首个也是唯一市值过千亿美元的生物公司(当然吉利德并非是100%的生物公司,参见1楼的评论)。
表2:2013年批准的新药中预计成为重磅药的(年销售额过10亿美元)
Drugs | Company | Forecast (billions of $US)* | |
Sofosbuvir (Sovaldi) | Gilead | 6.8‡ | |
Dimethyl fumarate (Tecfidera) | Biogen Idec | 6 | |
Ibrutinib (Imbruvica) | Pharmacyclics | 4.5 | |
Ado-trastuzumab emtansine (Kadcyla) | Genentech | 4.1 | |
Umeclidinium and vilanterol (Anoro Ellipta) | GlaxoSmithKline | 3.1 | |
Fluticasone and vilanterol (Breo Ellipta) | GlaxoSmithKline | 2.8 | |
Pomalidomide (Pomalyst) | Celgene | 1.8 | |
Canagliflozin (Invokana) | Janssen | 1.6 | |
Obinutuzumab (Gazyva) | Genentech | 1.5 | |
Dolutegravir (Tivicay) | ViiV | 1.4 | |
Afatinib (Gilotrif) | Boehringer Ingelheim | 1.3§ | |
Macitentan (Opsumit) | Actelion | 1 | |
Alogliptin (Nesina) | Takeda | 1|| | |
*All forecasts are consensus, annual, global sales estimates for 2019, as compiled by Thomson Reuters Cortellis, except where indicated otherwise. ‡The sofosbuvir sales estimates are for 2018. §The afatinib sales forecasts are from BioMedTracker, for 2018. ||The alogliptin sales forecast is for 2017, after which the drug is forecast to lose blockbuster status. | |||
2013年,只有两个单克隆抗体药获批,要远低于过去4年中平均每年获批6个单抗药的数量。但是这个变化并非代表了新的趋势。事实上,目前单抗药的研发管线充足,目前有近200种实验性单抗药在进行临床实验,其中有30种在进行III期临床实验,所以相信未来还会有更多的单抗药获批 (相关详细数据和信息可参见我的另一博文:聚焦生物仿制药(5):单抗药都是大公司的盛宴吗?)。上述两种单抗药均为罗氏旗下的基因泰克公司研发成功,这也使该公司获批的单抗药的数字达到了12种(含部分与其它公司联合开发的),迄今为止,FDA共批准了31种单抗药,基因泰克仅仅一家公司就占了超过三分之一,这也充分显示了基因泰克在单抗药领域的超强地位。上述的两个单克隆抗体药,其中一个为Ado-trastuzumab emtansine(在美国简称INN, 商标名Kadcyla)。这个药基于所谓的ADC技术(Antibody-Drug conjugates, 抗体偶联药物)的。对于该药以及ADC类药,我此前已经有过介绍(参见我的另一博文:2013年上半年美国FDA批准的新药),不再赘述。
Obinutuzumab(Gazyva)是2013年美国FDA批准的另外一种单抗药,靶向CD20,适应症为未治疗过的CLL(慢淋,一种白血病)。该药的亮点也颇多:如表1所示,同时拥有两种特殊地位: 即P,B,而P,B分别代表:1)Priority review(优先评审);2)Breakthrough designation status (突破性新药地位)。该药也是美国批准的第一个糖基工程化处理的单抗药(glyo-engineered mAb, 改变单抗药的糖基化位点,使其与抗原结合强度更大)。
值得一提的是,在过去四年中,研发成功一种新药的成本上升了18%,达到了13亿美元。但是每种新药平均预期销售峰值(每年)却下降了43%,从2010年8.16亿美元下降到了4.66亿美元 (4)。这一升一降加上专利悬崖等问题,就导致了近几年来欧美各大药企裁人没商量。(转化医学网360zhyx.com)
本文主要参考文献
 来源:王守业科学网博客
来源:王守业科学网博客 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发