Cell:全面解析明星受体(EGFR)激活的全部机制
| 导读 |
表皮生长因子受体EGFR是一种细胞表面蛋白,与多种癌症密切相关,也是癌症治疗的主要靶标。日前,美国Lawrence Berkeley国家实验室和加州大学Berkeley分校的研究人员,通过前沿技术完善了EGFR激活的详细机制,文章发表在Cell杂志上。
“我们对EGFR以及细胞生长/增殖的复杂分子机制了解得越多,就能够更好的开发新癌症疗法... |
表皮生长因子受体EGFR是一种细胞表面蛋白,与多种癌症密切相关,也是癌症治疗的主要靶标。日前,美国Lawrence Berkeley国家实验室和加州大学Berkeley分校的研究人员,通过前沿技术完善了EGFR激活的详细机制,文章发表在Cell杂志上。
“我们对EGFR以及细胞生长/增殖的复杂分子机制了解得越多,就能够更好的开发新癌症疗法,更有效的治疗多种癌症,”文章的通讯作者之一,化学家Jay Groves说。“通过时间分辨荧光光谱、核磁共振和计算机建模,我们确定了当配体(EGF)结合时,EGFR激活的全部机制。”文章的另一位通讯作者是John Kuriyan。
从高中生物课上,我们学到基因编码信息被翻译为特定蛋白。不过,许多蛋白必须经由翻译后程序激活,比如自身磷酸化。蛋白激活影响着许多重要的细胞过程,包括细胞增殖、分化和迁移。若EGFR出现故障使这些过程脱离控制,就会导致癌症。然而,尽管EGFR与癌症有着密切关联,人们对EGFR的激活机制还并不完全了解。
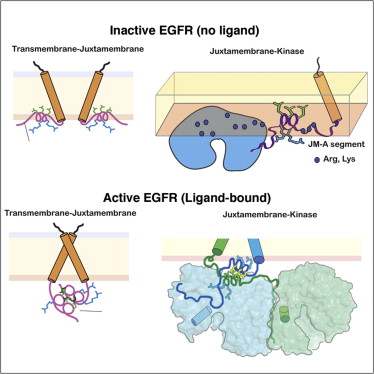
“受体酪氨酸激酶是一个细胞表面受体大家族,EGFR也是其中一员。EGFR有一个细胞外的配体结合域,和一个细胞内的激酶区域,” Groves说。“教科书上对EGFR激活的解释是,其配体EGF结合到配体结合域,诱导受体二聚化,随后二聚体的两个激酶区域相互磷酸化。”
Groves认为这一解释过于简单,因为在相对较低的浓度下,即使没有EGF诱导的二聚化,单独的激酶域在溶液中也能自激活。二聚化是指两个同样的分子聚合形成单个化合物。
研究人员发现,除了配体EGF结合以外,EGFR激活还需要EGFR跨膜螺旋和细胞膜附近区域发生结构偶联。正是这种结构偶联,允许配体存在时EGFR发生二聚化。
“未结合配体时,EGFR的构象使细胞内的激酶区域无法靠近,” Groves说。“当配体EGF结合时,这一限制解除,两个EGFR发生二聚化,然后彼此磷酸化。”
研究人员通过时间分辨荧光光谱技术,在活细胞中实时观察了当配体EGF激活EGFR时,EGFR移动并装配成二聚体的过程。由此,他们完全解析了EGFR的激活机制。下一步研究人员将利用时间分辨荧光光谱技术研究另一类酪氨酸激酶(Eph受体),和免疫系统中重要的T细胞受体。
“我们更大的目标是,通过这一新的定量技术,将生物学转化为硬物理科学,” Groves说。“从前我们是将观察到的现象拼贴起来进行简单描述,现在我们希望在物理学的基础上理解生物系统的作用机制。”
原文链接:
Conformational Coupling across the Plasma Membrane in Activation of the EGF Receptor
How the epidermal growth factor receptor (EGFR) activates is incompletely understood. The intracellular portion of the receptor is intrinsically active in solution, and to study its regulation, we measured autophosphorylation as a function of EGFR surface density in cells. Without EGF, intact EGFR escapes inhibition only at high surface densities. Although the transmembrane helix and the intracellular module together suffice for constitutive activity even at low densities, the intracellular module is inactivated when tethered on its own to the plasma membrane, and fluorescence cross-correlation shows that it fails to dimerize. NMR and functional data indicate that activation requires an N-terminal interaction between the transmembrane helices, which promotes an antiparallel interaction between juxtamembrane segments and release of inhibition by the membrane. We conclude that EGF binding removes steric constraints in the extracellular module, promoting activation through N-terminal association of the transmembrane helices.
来源:生物通
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发