ESR1
| 导读 | 概述
骨质疏松症症(osteoporosis)的特征是骨质丢失,表现为骨密度减低,骨量减少,骨小梁变窄成针状或撑杆状,且互不相连,造成骨的脆性增加并容易发生骨折。骨质疏松症乃由于各种原因引起的骨形成减少或骨吸收增强或两者兼而有之所致。雌激素是提高骨密度,防止绝经后骨丢失的重要因素,人成骨细胞和破骨细胞表面均发现有雌激素受体(estrogen r... |
概述
骨质疏松症症(osteoporosis)的特征是骨质丢失,表现为骨密度减低,骨量减少,骨小梁变窄成针状或撑杆状,且互不相连,造成骨的脆性增加并容易发生骨折。骨质疏松症乃由于各种原因引起的骨形成减少或骨吸收增强或两者兼而有之所致。雌激素是提高骨密度,防止绝经后骨丢失的重要因素,人成骨细胞和破骨细胞表面均发现有雌激素受体(estrogen receptor,ESR),这表明雌激素对骨细胞起着直接调控作用。ESR1是介导雌激素发挥生物学作用的核内生物大分子,随着对ESR1的研究日益深入,尤其是对ESR1基因多态性与绝经后骨质疏松症的关联性研究,使得从基因水平筛查骨质疏松症高危人群成为可能。
基因结构
ESR全称estrogen receptor alpha gene,即雌激素受体alpha基因,位于第6号染色体6q25位置。ESR基因全长29.5kb,由8个外显子和7个内含子组成,mRNA全长6,455nt,编码595个氨基酸残基组成的蛋白。
基因分子生物学功能
雌激素受体是一种核内受体,与其它类固醇激素受体一样,雌激素受体有雌激素结合域、DNA结合域及转录激活域。雌激素与其受体结合后形成二倍体,经过与包括热休克蛋白等多种核内蛋白质的相互作用,与DNA分子上特定的部位-雌激素应答元件(estrogen responsive element) 结合,激活靶基因进行转录,从而产生基因产物。
参与的通路
雌激素受体是一类有配体激活的核转录因子,介导大部分的雌激素反应[2],有两种信号传导途径。
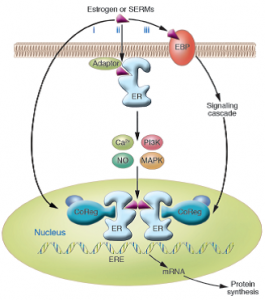
图1 雌激素信号传导通路
1. 基因组途径
a.配体依赖途径(1igand-dependent)
核内ESR未与配体结合时,以多蛋白抑制复合物的非活化形式存在。当结合配体后,引起变构形成同源二聚体,与靶基因调节区雌激素反应元件(estrogen response element,ERE)结合。之后,ER直接或间接通过辅激活物与转录元件作用,启动转录。辅激活物包括SRC-1、GRIP1、ACTR、CBP/p300、TRAP220、PGC-1和SRA等[1],ER与其相互作用可稳定转录前起始复合物,使ERE处的染色体变得疏松。转录能力与染色体组蛋白N端乙酰化有关,组蛋白乙酰化后可使组蛋白与DNA结合不稳定,从而使染色体结构疏松。因此,ESR活性所需的许多辅激活物是组蛋白乙酰转移酶(HATs),如p160辅激活物家族成员SRC-1和ACTR,它们通过重复的LXXLL氨基酸基序与ESRs的AF-2区结合,作为平台结合更多HATs,如p300、CBP和p300/CBP相关因子pCAF。与此相反,组蛋白去乙酰化酶(HDAcs)使组蛋白去乙酰化而抑制转录。当给予拮抗剂如他莫昔芬(Tamoxifen),ERα就与辅抑制物NCoR和SMRT结合[2]。这些辅抑制物通过结合HDAC复合物如Sin3复合物,而使转录受到抑制。
b.配体非依赖途径(1igand-independent)
多肽激素如表皮生长因子(EGF)、胰岛素样生长因子-1(IGF-1)、胞内信使类似物8-溴-cAMP也能激活ESR而促进靶基因表达[3]。大量研究表明,在该途径中ESR被细胞中的激酶磷酸化可能是关键[4]。当给予EGF或IGF后,被激活的蛋白激酶(MAPK)使ERα(ESR1)AF-1区的第118位丝氨酸磷酸化,从而使受体与ERα特异的辅激活物CoReg结合,活化靶基因[5]。同样,ESRβN末端的活化区也可被MAPK磷酸化,以不依赖配体的形式结合p160辅激活物SRC-1[6],继而再与ERE作用,减弱ERα配体激活的转录活性,因此同时表达两种受体亚型的细胞,总的雌激素效应可能取决于ERα/ERβ的比值。
c. 不依赖ERE的转录途径(ERE-independent)
ESR除了与ERE 结合产生效应外,也能与Fos和Jun作用而与DNA上的AP-1位点结合影响转录,同时ERα-Spl复合物也可结合富含GC的启动子序列。ERα和ERβ在AP-1位点处与雌激素结合后,表现为相反的作用;与ERα结合时,雌激素活化转录;而与ERβ结合时,雌激素抑制转录。另外,拮抗剂他莫昔芬、雷洛昔芬(raloxifene)在AP-1位点处与ERβ结合,则成为强有力的转录兴奋剂。
2.非基因组途径
在骨骼、乳腺、心血管和神经系统观察到E2的快速生物效应,提示雌激素可能有非转录途径,它通过膜ESR而与胞内信号转导蛋白发生作用。E2的一些心血管保护作用是由ERα非转录途径介导的,包括雌激素通过MAPK和磷脂酰肌醇激酶/Akt( PI3/Akt)途径双相活化内皮细胞中的一氧化氮合酶[7]。在成骨细胞和破骨细胞中,E2快速激活MAPK,可能参与了激素的增殖和抗凋亡效应,这也许是雌激素骨保护作用的一个机制[8]。
参考资料
[1].Shang, Y., et al., Cofactor dynamics and sufficiency in estrogen receptor-regulated transcription. Cell, 2000. 103(6): p. 843-52.
[2].Smith, C.L., Cross-talk between peptide growth factor and estrogen receptor signaling pathways. Biol Reprod, 1998. 58(3): p. 627-32.
[3].Ueda, S., et al., Alternative tyrosine phosphorylation of signaling kinases according to hormone receptor status in breast cancer overexpressing the insulin-like growth factor receptor type 1. Canc
[4].Lannigan, D.A., Estrogen receptor phosphorylation. Steroids, 2003. 68(1): p. 1-9.
[5].Kato, S., Estrogen receptor-mediated cross-talk with growth factor signaling pathways. Breast Cancer, 2001. 8(1): p. 3-9.[6]. Tremblay, A. and V. Giguere, Contribution of steroid receptor coactivator-1 and CREB binding protein in ligand-independent activity of estrogen receptor beta. J Steroid Biochem Mol Biol, 2001. 77(1
[7]. Paech, K., et al., Differential ligand activation of estrogen receptors ERalpha and ERbeta at AP1 sites. Science, 1997. 277(5331): p. 1508-10.
[8].Hisamoto, K. and J.R. Bender, Vascular cell signaling by membrane estrogen receptors. Steroids, 2005. 70(5-7): p. 382-7
骨质疏松症症(osteoporosis)的特征是骨质丢失,表现为骨密度减低,骨量减少,骨小梁变窄成针状或撑杆状,且互不相连,造成骨的脆性增加并容易发生骨折。骨质疏松症乃由于各种原因引起的骨形成减少或骨吸收增强或两者兼而有之所致。雌激素是提高骨密度,防止绝经后骨丢失的重要因素,人成骨细胞和破骨细胞表面均发现有雌激素受体(estrogen receptor,ESR),这表明雌激素对骨细胞起着直接调控作用。ESR1是介导雌激素发挥生物学作用的核内生物大分子,随着对ESR1的研究日益深入,尤其是对ESR1基因多态性与绝经后骨质疏松症的关联性研究,使得从基因水平筛查骨质疏松症高危人群成为可能。
基因结构
ESR全称estrogen receptor alpha gene,即雌激素受体alpha基因,位于第6号染色体6q25位置。ESR基因全长29.5kb,由8个外显子和7个内含子组成,mRNA全长6,455nt,编码595个氨基酸残基组成的蛋白。
基因分子生物学功能
雌激素受体是一种核内受体,与其它类固醇激素受体一样,雌激素受体有雌激素结合域、DNA结合域及转录激活域。雌激素与其受体结合后形成二倍体,经过与包括热休克蛋白等多种核内蛋白质的相互作用,与DNA分子上特定的部位-雌激素应答元件(estrogen responsive element) 结合,激活靶基因进行转录,从而产生基因产物。
参与的通路
雌激素受体是一类有配体激活的核转录因子,介导大部分的雌激素反应[2],有两种信号传导途径。

图1 雌激素信号传导通路
1. 基因组途径
a.配体依赖途径(1igand-dependent)
核内ESR未与配体结合时,以多蛋白抑制复合物的非活化形式存在。当结合配体后,引起变构形成同源二聚体,与靶基因调节区雌激素反应元件(estrogen response element,ERE)结合。之后,ER直接或间接通过辅激活物与转录元件作用,启动转录。辅激活物包括SRC-1、GRIP1、ACTR、CBP/p300、TRAP220、PGC-1和SRA等[1],ER与其相互作用可稳定转录前起始复合物,使ERE处的染色体变得疏松。转录能力与染色体组蛋白N端乙酰化有关,组蛋白乙酰化后可使组蛋白与DNA结合不稳定,从而使染色体结构疏松。因此,ESR活性所需的许多辅激活物是组蛋白乙酰转移酶(HATs),如p160辅激活物家族成员SRC-1和ACTR,它们通过重复的LXXLL氨基酸基序与ESRs的AF-2区结合,作为平台结合更多HATs,如p300、CBP和p300/CBP相关因子pCAF。与此相反,组蛋白去乙酰化酶(HDAcs)使组蛋白去乙酰化而抑制转录。当给予拮抗剂如他莫昔芬(Tamoxifen),ERα就与辅抑制物NCoR和SMRT结合[2]。这些辅抑制物通过结合HDAC复合物如Sin3复合物,而使转录受到抑制。
b.配体非依赖途径(1igand-independent)
多肽激素如表皮生长因子(EGF)、胰岛素样生长因子-1(IGF-1)、胞内信使类似物8-溴-cAMP也能激活ESR而促进靶基因表达[3]。大量研究表明,在该途径中ESR被细胞中的激酶磷酸化可能是关键[4]。当给予EGF或IGF后,被激活的蛋白激酶(MAPK)使ERα(ESR1)AF-1区的第118位丝氨酸磷酸化,从而使受体与ERα特异的辅激活物CoReg结合,活化靶基因[5]。同样,ESRβN末端的活化区也可被MAPK磷酸化,以不依赖配体的形式结合p160辅激活物SRC-1[6],继而再与ERE作用,减弱ERα配体激活的转录活性,因此同时表达两种受体亚型的细胞,总的雌激素效应可能取决于ERα/ERβ的比值。
c. 不依赖ERE的转录途径(ERE-independent)
ESR除了与ERE 结合产生效应外,也能与Fos和Jun作用而与DNA上的AP-1位点结合影响转录,同时ERα-Spl复合物也可结合富含GC的启动子序列。ERα和ERβ在AP-1位点处与雌激素结合后,表现为相反的作用;与ERα结合时,雌激素活化转录;而与ERβ结合时,雌激素抑制转录。另外,拮抗剂他莫昔芬、雷洛昔芬(raloxifene)在AP-1位点处与ERβ结合,则成为强有力的转录兴奋剂。
2.非基因组途径
在骨骼、乳腺、心血管和神经系统观察到E2的快速生物效应,提示雌激素可能有非转录途径,它通过膜ESR而与胞内信号转导蛋白发生作用。E2的一些心血管保护作用是由ERα非转录途径介导的,包括雌激素通过MAPK和磷脂酰肌醇激酶/Akt( PI3/Akt)途径双相活化内皮细胞中的一氧化氮合酶[7]。在成骨细胞和破骨细胞中,E2快速激活MAPK,可能参与了激素的增殖和抗凋亡效应,这也许是雌激素骨保护作用的一个机制[8]。
参考资料
[1].Shang, Y., et al., Cofactor dynamics and sufficiency in estrogen receptor-regulated transcription. Cell, 2000. 103(6): p. 843-52.
[2].Smith, C.L., Cross-talk between peptide growth factor and estrogen receptor signaling pathways. Biol Reprod, 1998. 58(3): p. 627-32.
[3].Ueda, S., et al., Alternative tyrosine phosphorylation of signaling kinases according to hormone receptor status in breast cancer overexpressing the insulin-like growth factor receptor type 1. Canc
[4].Lannigan, D.A., Estrogen receptor phosphorylation. Steroids, 2003. 68(1): p. 1-9.
[5].Kato, S., Estrogen receptor-mediated cross-talk with growth factor signaling pathways. Breast Cancer, 2001. 8(1): p. 3-9.[6]. Tremblay, A. and V. Giguere, Contribution of steroid receptor coactivator-1 and CREB binding protein in ligand-independent activity of estrogen receptor beta. J Steroid Biochem Mol Biol, 2001. 77(1
[7]. Paech, K., et al., Differential ligand activation of estrogen receptors ERalpha and ERbeta at AP1 sites. Science, 1997. 277(5331): p. 1508-10.
[8].Hisamoto, K. and J.R. Bender, Vascular cell signaling by membrane estrogen receptors. Steroids, 2005. 70(5-7): p. 382-7
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发