【STTT】广州医科大学钟南山团队最新发文
| 导读 | SARS-CoV-2感染破坏上皮屏障并引发气道炎症。冠状病毒的核心毒力结构成分包膜(E)蛋白可能在这一过程中发挥作用。 |
2024年3月25日,广州医科大学钟南山团队在《Signal Transduction and Targeted Therapy》在线发表题为”SARS-CoV-2 envelope protein impairs airway epithelial barrier function and exacerbates airway inflammation via increased intracellular Cl− concentration“的研究论文,该研究证明了E蛋白下调紧密连接蛋白的表达,导致气道上皮屏障的破坏。

https://www.nature.com/articles/s41392-024-01753-z
研究背景
01
SARS-CoV-2是导致COVID-19大流行的病原体,对全球公共卫生构成了重大挑战。SARS-CoV-2可能破坏肺泡上皮屏障,引发气道炎症加剧,导致呼吸困难,严重时进展为急性呼吸衰竭。然而,上皮屏障功能破坏和炎症增强的确切分子机制尚不完全清楚。了解SARS-CoV-2的致病机制有助于确定临床干预的新靶点。SARS-CoV-2是一种包膜病毒,具有正义单链RNA基因组。该病毒可破坏上皮细胞的完整性,加剧呼吸道上皮细胞的炎症,这是抵御病毒感染的第一道防线。
SARS-CoV-2编码四种结构蛋白——刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)。S蛋白介导病毒与宿主受体血管紧张素转换酶2 (ACE2)的结合和病毒与细胞膜的融合。M蛋白在病毒组装中起着至关重要的作用,而N蛋白对病毒基因组的包装和存活至关重要。值得注意的是,E蛋白是一种核心结构毒力因子,在维持病毒生命周期(如病毒组装)中起着至关重要的作用。一些研究探索了SARS-CoV-2 S、M和N蛋白的致病作用。然而,SARS-CoV-2 E蛋白在上皮紧密连接和粘膜炎症中的作用和机制尚不清楚。
研究进展
02
鉴于E蛋白以PDE4-cAMP依赖的方式增加[Cl−]i,研究人员研究了靶向PDE4的药物对E蛋白介导的[Cl−]i升高和气道炎症的潜在保护作用。罗利普兰,一种选择性PDE4抑制剂,消除了E蛋白在人气道上皮细胞和mPAECs中引起的[Cl−]i升高。此外,罗利普兰治疗减轻了气道上皮细胞中IκB的磷酸化和促炎性细胞因子/趋化因子的上调。重要的是,在SARS-CoV-2 E蛋白刺激的小鼠气管内灌注模型中,罗利普兰抑制了mPAECs中升高的[Cl−]i,并在肺组织中发挥抗炎作用。这些结果表明,针对PDE4抑制的药理学干预可能有效地减轻气道上皮细胞内的细胞内Cl−积累,并减轻SARS-CoV-2感染引起的气道炎症。
为了验证上述发现,研究人员最终采用了hPAECs模型。有趣的是,E蛋白下调了hPAECs中ZO-1和闭合蛋白的表达,而claudin-4的表达则不受影响。此外,E蛋白引发了过度的炎症反应,其特征是促炎细胞因子的表达增加,以及hPAECs中JNK、IκB和SGK1的磷酸化水平升高。与在人气道上皮细胞系中的观察结果一致,E蛋白没有改变CFTR的表达,而是增加了PDE4亚型的表达,导致hPAECs中Cl−的异常积累。这些结果进一步证实了SARS-CoV-2 E蛋白在破坏气道上皮完整性、促进炎症反应和扰乱气道上皮细胞内Cl−稳态中的作用。
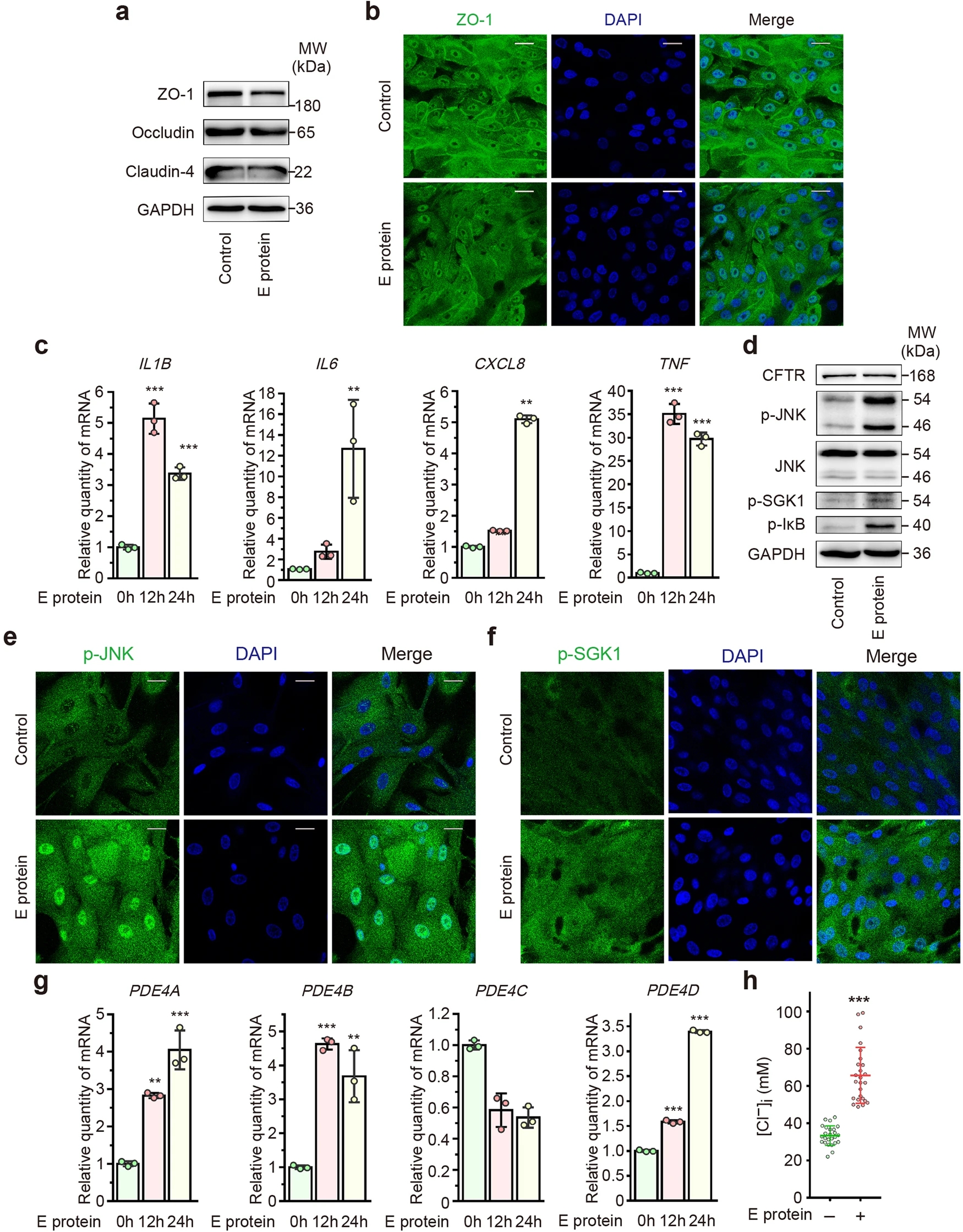
SARS-CoV-2包膜蛋白通过增加细胞内Cl−浓度损害气道上皮屏障功能并加重气道炎症
研究结论
03
总之,SARS-CoV-2 E蛋白下调紧密连接蛋白,破坏气道上皮屏障的完整性。此外,E蛋白通过TLR2/4-JNK-AP-1信号通路上调PDE4表达,显著降低细胞内cAMP水平,导致CFTR介导的Cl−转运受损。本研究结果为E蛋白促进气道上皮细胞内Cl−水平的积累,从而加剧炎症反应提供了新的视角。旨在提高cAMP水平以打开CFTR的治疗干预,或使用CFTR拮抗剂和SGK1抑制剂以消除细胞内炎症级联反应的治疗干预,可能有望减轻SARS-CoV-2诱导的气道炎症。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41392-024-01753-z
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发