再取进展!中国医学科学院北京协和医学院发文
| 导读 | 抑制T细胞浸润会抑制抗肿瘤免疫并引起对免疫检查点阻断(ICB)治疗的耐药性。 |
9月15日,中国医学科学院北京协和医学院学者在《Nature Communications》上发表题为“Activation of melanocortin-1 receptor signaling in melanoma cells impairs T cell infiltration to dampen antitumor immunity”的研究论文,研究暗示MC1R是黑色素瘤免疫治疗靶点,并建议GNAS-PKA信号传导是一种抑制抗肿瘤T细胞反应的泛癌致癌途径。

https://www.nature.com/articles/s41467-023-41101-3#Abs1
研究背景
免疫系统在疾病进展的整个过程中与肿瘤紧密结合,从早期肿瘤形成到转移。有效的抗肿瘤免疫依赖于先天免疫系统和适应性免疫系统,涉及多个步骤,包括抗原呈递细胞(APC)处理和呈递肿瘤抗原,激活抗原特异性T细胞,将效应T细胞转运到肿瘤中,然后由T细胞识别和消除癌细胞。随着疾病的进展,肿瘤可以发展出多种机制来逃避免疫监视。这些机制包括选择避免免疫识别的肿瘤变异(称为免疫编辑),在肿瘤微环境中产生免疫抑制介质,肿瘤反应性细胞毒性T淋巴细胞(CTL)对杀伤的抵抗力,以及抑制肿瘤中免疫细胞积累。
对肿瘤免疫逃避机制的理解促进了免疫治疗药物在癌症治疗中产生的显著临床疗效。然而,尽管使用了PD-L1表达、肿瘤突变负荷和错配修复缺陷等预测性生物标志物,但ICB的治疗益处仅限于每种癌症类型的一部分患者。因此,扩展我们对促进肿瘤免疫逃避的其他机制的了解对于改善癌症免疫疗法仍然至关重要。
体内CRISPR筛选确定Mc1r为B16F10黑色素瘤的候选免疫逃避基因
为了模拟肿瘤微环境(TME)中缺乏T细胞浸润的肿瘤,我们使用了小鼠黑色素瘤细胞系B16F10,该细胞系形成免疫细胞浸润低的肿瘤,并在移植到同系小鼠中时逃避免疫监视。为了揭示B16F10中免疫逃逸的遗传驱动因素,我们进行了汇总的CRISPR敲除筛选,以确定在存在完整免疫系统的情况下移植的B16F10细胞在体内的生长和/或存活所必需的基因,但对于体外培养细胞的生长和/或存活是可有可无的。
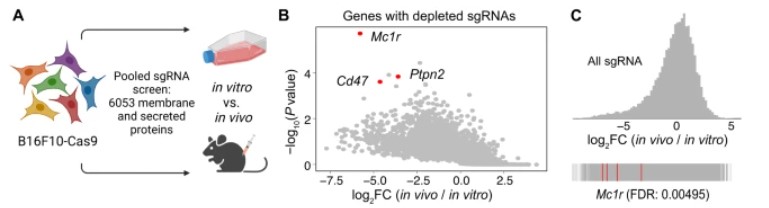
体内CRISPR筛选将Mc1r确定为B16F10黑色素瘤免疫逃逸的介质
与之前使用体内CRISPR筛选来鉴定帮助B16F10逃避免疫监视的高表达基因的研究相比,我们的筛选检查了6,053个编码膜相关或分泌蛋白的基因,因为这些基因更有可能介导TME中癌细胞和免疫细胞之间的通信。我们将定制的sgRNA文库转导到稳定表达Cas9的B16F10黑色素瘤细胞中,然后将转导的细胞体外培养或移植到野生型小鼠的背侧进行体内肿瘤生长(图1A)。两周后,我们从死亡小鼠身上收获了6-8个肿瘤,并使用Illumina测序将它们的sgRNA表征与体外培养的B16F10细胞的sgRNA表征进行比较。通过应用MAGeCK(基于模型的全基因组CRISPR / Cas9敲除分析)算法根据体内相对于体外的sgRNA耗竭对基因进行排名,我们鉴定了编码已知免疫逃避介质(Cd47和Ptpn2)的基因。我们还确定了已知的肿瘤生长抑制因子(Nf2和Kirrel)。此外,我们确定Mc1r是介导B16F10黑色素瘤免疫逃逸的候选基因。
研究结果
通过对雌性小鼠B16F10黑色素瘤进行体内CRISPR筛选,我们报道了黑色素瘤细胞中黑色皮质素-1受体(MC1R)的缺失激活抗肿瘤T细胞反应并克服了对ICB的耐药性。另一种黑色素细胞黑色素瘤模型HCmel1274的MC1R消耗也增强了ICB的疗效。通过激活GNAS-PKA轴,MC1R抑制干扰素-γ诱导的CXCL9/10/11转录,从而损害T细胞浸润到肿瘤微环境中。在人黑色素瘤中,高 MC1R 表达与 CXCL9/10/11 表达降低、T 细胞浸润受损和患者预后不良相关。虽然MC1R激活仅限于黑色素瘤,但在不同的癌症类型中观察到热点突变的GNAS激活,并且与CXCL9/10/11表达降低有关。
综上所述,MC1R是黑色素瘤免疫治疗靶点,并建议GNAS-PKA信号传导是一种抑制抗肿瘤T细胞反应的泛癌致癌途径。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-41101-3#Abs1
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发