【Nature子刊】重磅!哈佛医学院研究团队发现抑制肿瘤新策略
| 导读 | 虽然针对BRAF(V600E)的靶向治疗可提高黑色素瘤患者的生存率,但许多人会出现癌症复发。 |
6月5日,哈佛医学院Pere Puigserver等在《Nature Communications》上发表研究论文“Epigenetic suppression of PGC1α(PPARGC1A) causes collateral sensitivity to HMGCR-inhibitors within BRAF-treatment resistant melanomas”,研究表明,对BRAF靶向治疗的慢性适应推动了新的侧支代谢脆弱性,HMGCR抑制剂可能提供一种治疗PGC1α表达抑制复发的黑色素瘤的策略。

https://www.nature.com/articles/s41467-023-38968-7
研究背景
BRAF和MEK抑制剂联合治疗是针对携带BRAF V600错义突变的黑色素瘤的有效疗法。虽然大多数患者对这种治疗方式有反应,但由于癌细胞的进化和适应能力,许多人会看到他们出现肿瘤复发,这有效地抑制了其长期生存的前景。这种状况被称为治疗耐药性,或者在初始癌症中相对罕见,并且当复发时出现显著延迟时被称为癌细胞持久性。
目前,已经确定了导致靶向BRAF治疗耐药性的多种机制,包括:(i)促进生长的成分(如NRAS或MEK)中的基因突变,这些突变重新激活了MAPK途径以及PI3K/AKT通路的过度激活;(ii)在药物存在下促进RAF二聚化和下游信号传导的BRAF基因的替代剪接;(iii)肿瘤微环境变化,如缺氧或生长因子分泌增加,可使黑色素瘤细胞对BRAF抑制剂脱敏。此外,与治疗耐药性相关的黑色素瘤表型转换可能涉及表观遗传和代谢变化。
目前尚不完全清楚靶向BRAF耐药性是否普遍存在,还是仅在少数癌细胞群中预先存在。重要的是,尚不清楚是否有任何潜在机制可用于告知治疗耐药性,以及联合治疗策略是否可以预防或针对新出现的耐药性。
研究进展
我们之前发现了一个黑色素瘤亚群,由依赖PGC1α(PPARGC1A编码)定义,其作用是促进线粒体功能和氧化应激存活,包括 BRAF 靶向治疗的效果。然而,高水平的PGC1α也抑制了侵袭性黑色素瘤性状,因此这种线粒体生物发生的转录共激活剂和主调节因子平衡了生长和存活与侵袭和转移扩散的生长和存活。
为了确定慢性BRAF抑制剂治疗后PGC1α水平降低的机制,我们评估了PPARGC1A启动子区域的表观遗传组蛋白标记的变化,发现抑制性H3K27me3增加,活性H3K27ac标记减少。有趣的是,H3K27me3标记由EZH2催化,我们发现EZH2在慢性BRAF抑制剂处理的细胞中上调,其中PPARGC1A水平降低,从而强调了EZH2在PPARGC1A沉默中的作用。用EZH2抑制剂工具化合物3-脱氮烷平原菌素A(DZNep)或临床批准的tazemetostat治疗,增加PGC1α表达,并在功能上减少黑色素瘤细胞迁移。
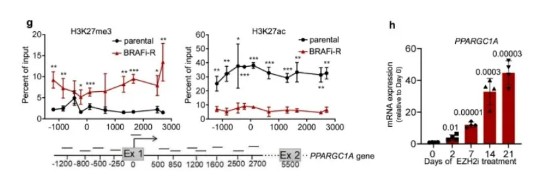
总的来说,这些结果表明,在黑色素瘤细胞的一个亚群中,慢性BRAF抑制剂治疗可引起表观遗传适应,包括PPARGC1A抑制和侵袭性黑色素瘤性状的获得。
研究成果
总的来说,我们的研究表明PGC1α的表观遗传抑制定义了慢性BRAF抑制剂治疗的黑色素瘤的侵袭性亚群。以代谢为中心的药理学筛查进一步确定他汀类药物(HMGCR 抑制剂)是 PGC1α 抑制的 BRAF 抑制剂耐药性黑色素瘤中的附带易感。较低的PGC1α水平机械地导致RAB6B和RAB27A表达降低,从而它们的联合再表达逆转了他汀类药物的脆弱性。PGC1α 减少的 BRAF 抑制剂耐药细胞增加了整合素-FAK 信号传导并改善了细胞外基质分离的生存线索,这有助于解释其转移能力的增加。他汀类药物治疗通过降低 RAB6B 和 RAB27A 异戊烯化来阻断细胞生长,从而减少其膜缔合并影响整合素定位和生长所需的下游信号传导。这些结果表明,对BRAF靶向治疗的慢性适应推动了新的侧支代谢脆弱性,并且HMGCR抑制剂可能提供一种治疗PGC1α表达抑制的黑色素瘤的策略。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-38968-7
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发