祝贺!迈杰医学伴随诊断合作伙伴君实生物特瑞普利单抗联合化疗治疗三阴性乳腺癌患者研究成果发表于《自然-医学》
| 导读 | 迈杰医学与君实生物正在共同推进JS311试剂盒在中国大陆的伴随诊断的注册,期待将来能够使更多中国TNBC患者受益于新的治疗策略。 |

2024年1月,君实生物自主研发的抗PD-1单抗药物特瑞普利单抗与白蛋白结合型紫杉醇 (nab-P) 联合治疗初诊IV期或复发转移性三阴性乳腺癌 (TNBC) 的III期TORCHLIGHT研究成果在国际顶尖医学期刊《自然-医学》 (Nature Medicine, IF=82.9) 发表。TORCHLIGHT研究比较了特瑞普利单抗与安慰剂联合nab-p治疗转移性或复发性TNBC的疗效和安全性。该研究结果显示,特瑞普利单抗联合nab-P可显著提高PD-L1阳性人群(JS311 CPS≥1)转移性或复发性TNBC患者的无进展生存期(PFS)。在PD-L1阳性和ITT人群中均观察到特瑞普利单抗联合nab-P组患者有明显的总生存期(OS)获益趋势。该项研究中PD-L1检测使用的JS311抗体试剂的分析性能由迈杰医学中心实验室验证,迈杰医学与君实生物正在共同推进JS311试剂盒在中国大陆的伴随诊断的注册,期待将来能够使更多中国TNBC患者受益于新的治疗策略。

图2:JS311抗体试剂的分析性能于迈杰医学中心实验室验证
免疫检查点PD-1通路抑制剂极大地改变了包括三阴性乳腺癌(TNBC)在内的各种恶性肿瘤的治疗管理。TORCHLIGHT是一项随机、双盲的3期试验,用于评估特瑞普利单抗和白蛋白紫杉醇(nab-P)(n = 353;实验组)VS 安慰剂和nab-P(n = 178;对照组)治疗转移性/复发性TNBC患者的疗效和安全性。主要终点是PFS,对PD-L1阳性和意向治疗人群进行盲态独立中心评估(BICR),次要终点包括OS和安全性。其中,特瑞普利单抗组和安慰剂组分别有200例和100例病人患有PD-L1阳性TNBC。
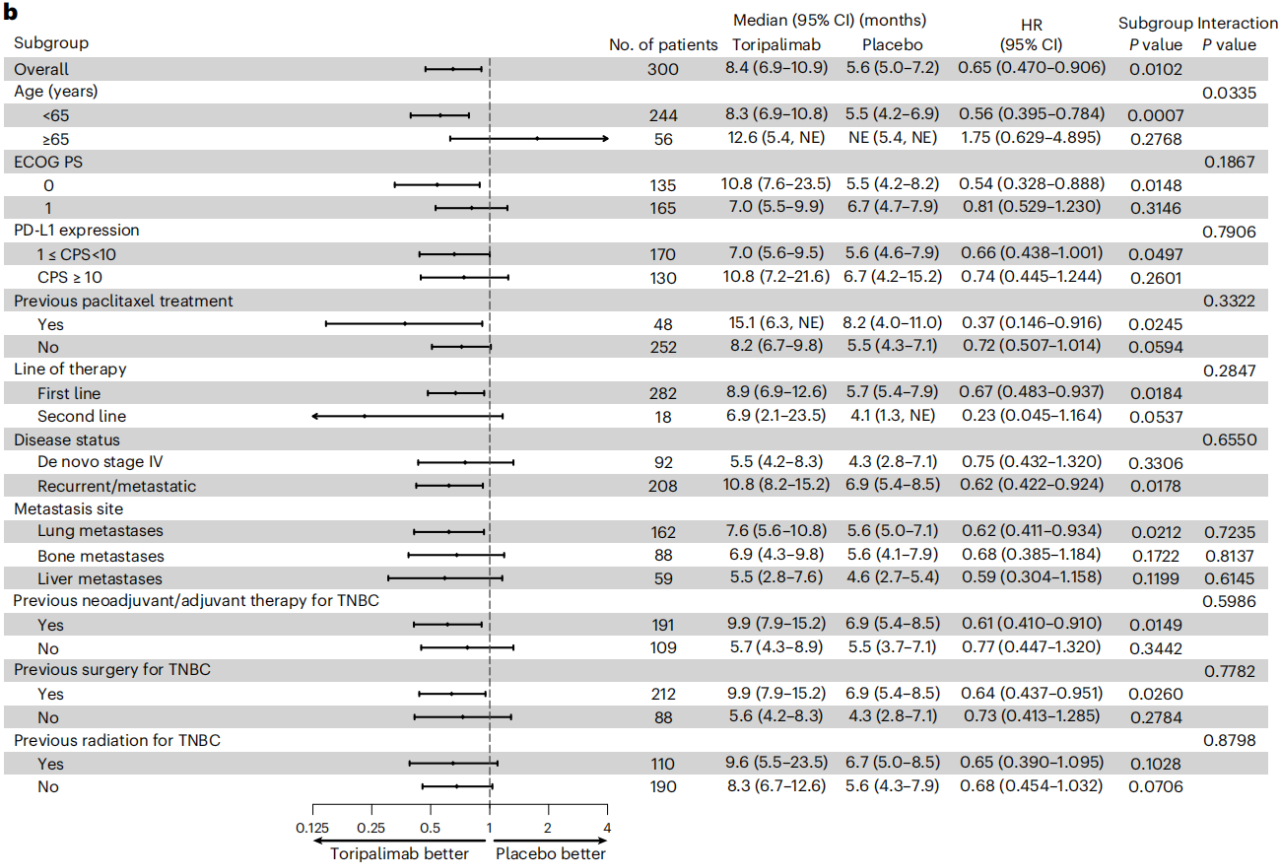
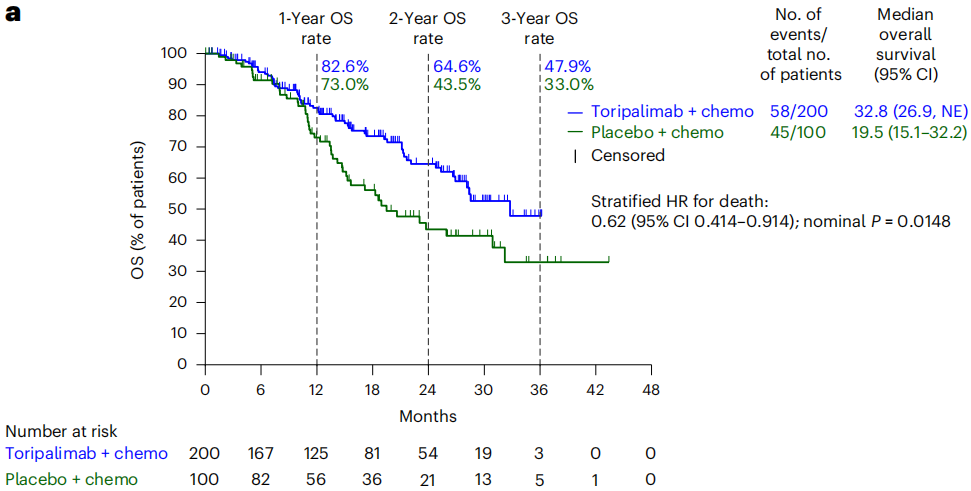
期中分析时,在PD-L1阳性人群的试验组中发现PFS显著改善,且有统计学意义,中位PFS为8.4个月VS 5.6个月,中位OS为32.8个月 VS 19.5个月。此外,试验组和对照组在治疗期间的不良事件(AE)发生率(99.2% VS 98.9%),≥3级AE发生率(56.4% VS 54.3%)和导致死亡AE发生率(0.6% VS 3.4%)均相似。这说明在nab-P中加入特瑞普利单抗可显著改善PD-L1阳性转移性/复发性TNBC患者的PFS,且安全性可耐受。
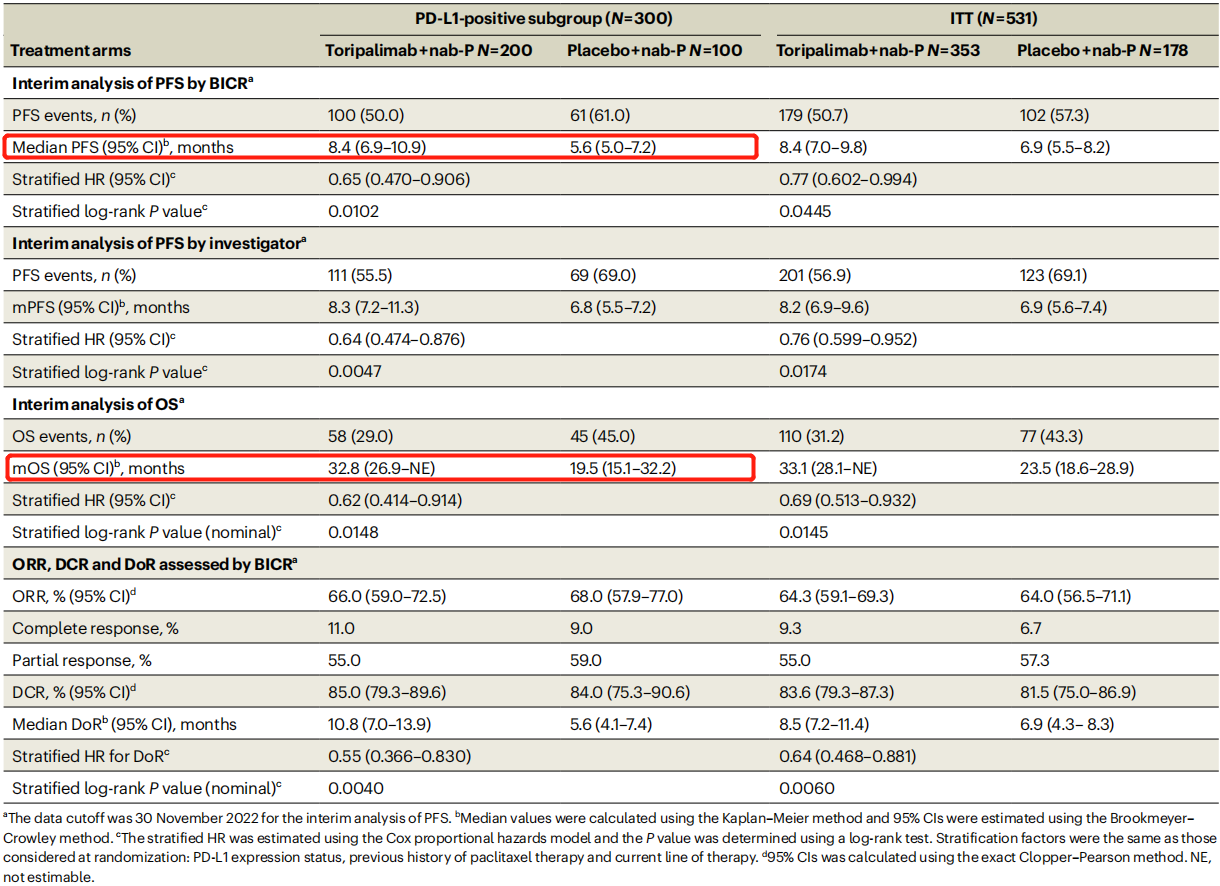
- 无进展生存期

- 总体生存率
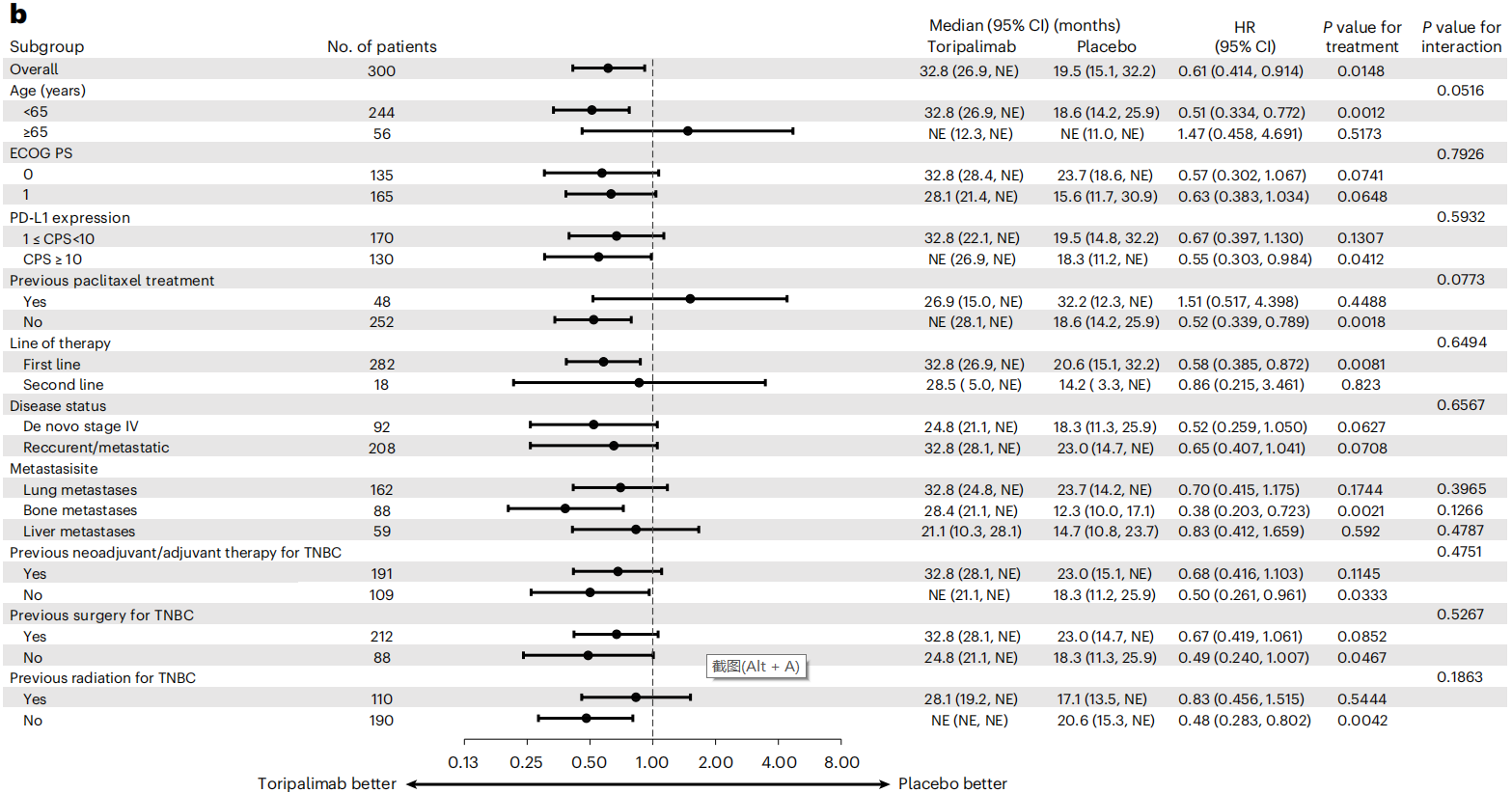
在nab-紫杉醇中加入特瑞普利单抗可显著改善PD-L1阳性(JS311 CPS ≥ 1)转移性/复发性TNBC患者的PFS ,同时安全性可耐受。分析显示,试验组的mPFS改善了2.8个月,疾病进展或死亡的风险降低了35%,PD-L1阳性患者的OS亦有改善趋势。总而言之,TORCHLIGHT研究的结果进一步验证了在化疗中添加PD-1检查点阻断剂治疗中国晚期TNBC患者人群的临床价值。
文献网址:https://www.nature.com/articles/s41591-023-02677-x


 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发