【Adv. Sci.】最新!国内学者揭示“癌中之王”胰腺癌进展机制
| 导读 | 胰腺导管腺癌(PDAC)是一种高度侵袭性和难治性疾病,5年生存率较低。 |
11月28日,南京医科大学马长艳、姚兵和南京大学曾科共同通讯在期刊《ADVANCED SCIENCE》上在线发表题为“EBF2 Links KMT2D-Mediated H3K4me1 to Suppress Pancreatic Cancer Progression via Upregulating KLLN”的研究论文,研究人员筛选出EBF2作为一种新型的H3K4me1结合蛋白,EBF2和KMT2D共同调节H3K4me1,在KLLN上起到强烈的激活作用,并抑制胰腺导管腺癌(PDAC)的进展。H3K4me1组蛋白修饰与KLLN转录之间的相互作用可以被利用来设计PDAC的新型治疗策略。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202302037
研究背景
01
胰腺导管腺癌(PDAC)是一种高度侵袭性和难治性疾病,5年生存率较低。根据2020年全球癌症统计数据,全球报告了495773例新病例和466003例死亡病例,PDAC在全球的发病率排名第14位,死亡率排名第7位(占所有致癌死亡的4.7%)。PDAC可能由多个因素引起,包括吸烟、糖尿病、肥胖、饮食因素、酗酒、种族、家族史和遗传因素,但其致病机制仍未完全理解。
组蛋白尾部的共价修饰在调节染色质结构和控制转录活性中发挥着基本作用。已经确定组蛋白赖氨酸甲基化是真核基因组表观遗传调控中的一个关键修饰。在这种修饰过程中,组蛋白H3或H4上的赖氨酸残基,如H3K4、H3K9、H3K27和H4K20,会发生单甲基化、双甲基化或三甲基化。新兴证据凸显了组蛋白赖氨酸甲基化受到组蛋白赖氨酸甲基转移酶(KMTs)和去甲基化酶(KDMs)的动态调控。由KMT2D催化并由LSD1去除,H3K4me1在转录控制中是一个重要的表观遗传调节因子。H3K4me1作为一个结合位点,和与基因转录相关的表观遗传调控因子或因素发生相互作用,包括染色质重塑因子、组蛋白乙酰转移酶和转录因子。
EBF2是一种具有基本螺旋环螺旋(bHLH)结构域的转录因子,参与棕色和米色脂肪细胞的分化和功能。全基因组ChIP-seq映射和分析揭示了EBF2优先移动到棕色脂肪特异基因的增强子区域,从而增加RNA聚合酶II和H3K27ac标记在棕色脂肪选择性顺式元件上的占有率。然而,EBF2及其相关分子在胰腺导管腺癌(PDAC)发病机制中的作用尚不清楚。
研究发现
02
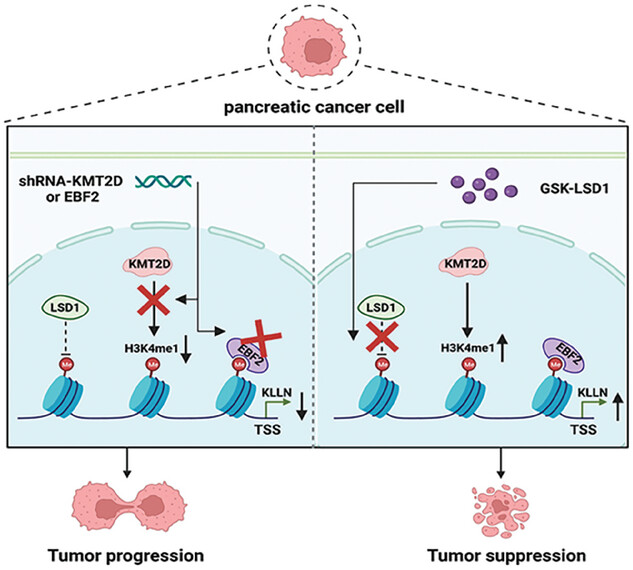
本研究发现,早期B细胞因子2(EBF2)是H3K4me1的结合蛋白。通过RNA-seq和ChIP-seq数据的分析,研究人员进一步发现在胰腺导管腺癌(PDAC)细胞中,KMT2D和EBF2在转录因子KLLN的调控下起到重要作用。KMT2D依赖的H3K4me1和EBF2主要位于KLLN基因转录起始位点(TSS)附近。全面的功能实验表明,KMT2D和EBF2通过上调KLLN协同抑制PDAC细胞的增殖、迁移和侵袭。通过使用GSK-LSD1,一种选择性抑制赖氨酸特异性去甲基化酶1(LSD1)的药物,可以通过增加H3K4me1水平来抑制PDAC的进展。这些发现揭示了PDAC进展的新机制,并为PDAC的治疗提供了潜在的治疗靶点。
EBF2抑制胰腺导管腺癌细胞的增殖和转移
03

为评估PDAC组织中EBF2的表达,研究人员构建了一个包括90对PDAC和相应邻近正常组织样本的组织微阵列(TMA)。经过IHC染色处理后,TMA显示EBF2主要位于正常和PDAC肿瘤细胞的细胞核内。H分数显示,与正常组织相比,PDAC组织中EBF2蛋白水平显著下调。EBF2的表达水平与PDAC患者的肿瘤分期、淋巴结转移和远端转移呈负相关。Kaplan-Meier生存曲线显示,EBF2表达水平较低与较差的生存率显著相关。
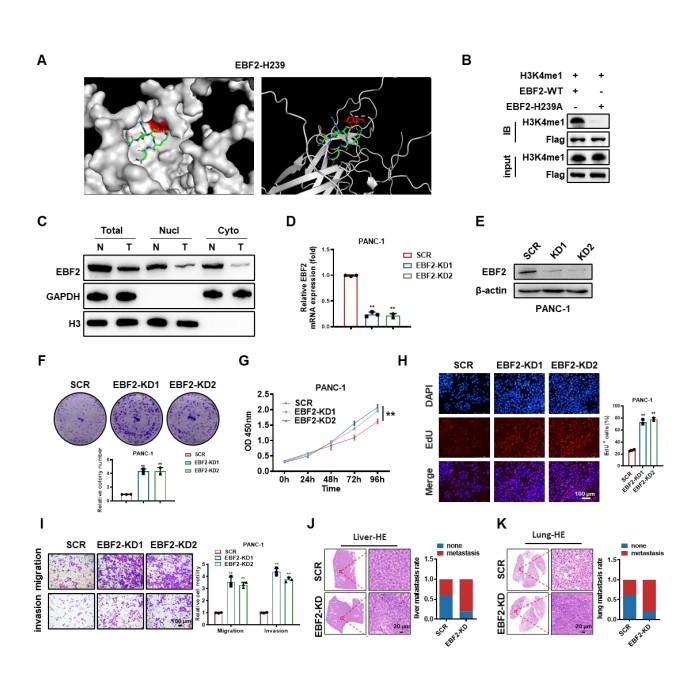
为评估EBF2对PDAC细胞生物学行为的影响,研究人员通过puromycin筛选获得稳定表达EBF2 shRNA的SW1990和PANC-1细胞系。通过qPCR和Western blot验证了EBF2在SW1990和PANC-1细胞中的缺失。使用CCK-8、EdU、克隆形成和Transwell实验评估了EBF2对PDAC细胞体外增殖、迁移和侵袭的影响。EBF2缺失的SW1990和PANC-1细胞比对照组细胞表现出更明显的增殖、迁移和侵袭能力。此外,沉默EBF2显著促进了SW1990-luc异种移植瘤的生长。为了检查SW1990细胞在体内的转移行为,研究人员将EBF2缺失的SW1990-luc细胞注入BALB/c小鼠的尾静脉。通过活体成像观察,研究人员发现EBF2缺失促进了小鼠肺部转移病灶的形成。H&E染色显示,注入EBF2缺失SW1990-luc细胞的小鼠肝和肺转移均有所增加。这些数据与EBF2下调与PDAC进展的关联一致。
研究结果
04
综上所述,研究人员筛选出EBF2作为一种新型的H3K4me1结合蛋白,EBF2和KMT2D共同调节H3K4me1,在KLLN上起到强烈的激活作用,并抑制胰腺导管腺癌(PDAC)的进展。H3K4me1组蛋白修饰与KLLN转录之间的相互作用可以被利用来设计PDAC的新型治疗策略。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202302037
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发