肿瘤转移的“新克星”!南华/湘雅/北大学者联合发文
| 导读 | 光动力疗法(PDT)因其疗效显著而在肿瘤治疗中得到广泛应用。然而,由血管异常引起的肿瘤缺氧微环境严重限制了PDT的疗效。此外,异常的血管系统与免疫治疗的失败有关。 |
近日,南华大学/中南大学湘雅医院/北京大学研究学者在权威期刊《Advanced Science》上发表了题为“Near-Infrared-II Nanoparticles for Vascular Normalization Combined with Immune Checkpoint Blockade via Photodynamic Immunotherapy Inhibit Uveal Melanoma Growth and Metastasis”的研究论文,本研究中,研究人员介绍了一种新型纳米粒子,命名为Combo-NP,由可生物降解的NIR II荧光伪共轭聚合物(TPA-BD)和血管抑制剂乐伐替尼组成,其主链上具有二硫键。Combo-NP具有双重功能,不仅可以诱导细胞毒性活性氧(ROS)直接消除肿瘤细胞,还可以诱导免疫原性细胞死亡(ICD)。这种ICD反应反过来又启动了一系列强大的免疫反应,从而增加了细胞毒性T淋巴细胞(ctl)的产生。此外,Combo-NP通过使肿瘤血管系统正常化来解决肿瘤缺氧问题。这一正常化过程增强了PDT的疗效,同时促进了肿瘤微环境中ctl的浸润。这些协同效应协同增强了纳米颗粒的光动力免疫治疗特性。此外,当与抗程序性死亡配体1 (anti-programmed death-ligand 1, PD-L1)联合使用时,它们对肿瘤转移表现出显著的抑制作用。本研究介绍了一种创新的纳米药物策略,旨在引发治疗葡萄膜黑色素瘤的全身抗肿瘤免疫反应。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202206932
研究背景
01
葡萄膜黑色素瘤(UM)是一种侵袭性恶性肿瘤,起源于眼睛的黑色素细胞。尽管通过放射治疗或手术有效地控制了原发肿瘤,但50%的UM患者会发展为转移性疾病。UM的总生存率很低,迄今为止,没有标准的方法来同时靶向原发性UM和防止进一步的转移。
光动力疗法(PDT)因其有效、无创、安全等优点成为治疗眼内肿瘤的有效方法。在典型的PDT过程中,有两种方法可以杀死肿瘤。一方面,光敏剂在光照下通过产生细胞毒性活性氧(ROS)直接杀伤肿瘤;另一方面,PDT可诱导免疫原性细胞死亡(ICD),刺激肿瘤细胞释放损伤相关分子模式(DAMPs)和肿瘤相关抗原(TAAs),触发树突状细胞(DCs)成熟和扩增T淋巴细胞浸润,从而逆转"冷肿瘤"为"热肿瘤"进行免疫治疗。然而,这种光动力免疫疗法受到血管异常导致肿瘤乏氧这一主要障碍的极大限制,特别是对于实体瘤,它们通常具有异质性的细胞生长超过其血供,从而导致肿瘤部位的氧浓度非常低(乏氧),并增加了乏氧诱导因子和血管内皮生长因子(VEGF)的表达。导致促血管生成因子和抗血管生成因子的失衡,最终导致功能和结构异常的血管表达增加。这些异常的血管网以排列紊乱、不成熟、高通透性为特征。肿瘤血管的异常导致缺氧,进而减少ROS的生成。此外,异常的血管导致肿瘤特异性细胞毒性T淋巴细胞(ctl)在肿瘤部位的浸润和活性有限。此外,异常的血管还通过招募免疫抑制性免疫细胞进入肿瘤微环境(TME)促进免疫逃逸。最近的研究表明,多靶点酪氨酸激酶抑制剂仑伐替尼可抑制血管内皮生长因子受体(VEGFRs)1 ~ 3、成纤维细胞因子受体(FGFRs)1 ~ 4和血小板源性生长因子受体(PDGFR) α,使血管正常化。因此,这可以缓解缺氧和增加免疫反应,从而增强PDT的效果。
研究进展
02
良好的生物相容性和较低的全身毒性是生物医学应用的先决条件。随后,通过KM小鼠尾静脉注射Len-NP、PDT-NP和Combo-NP,评价其生物安全性。随后,构建了OCM1小鼠皮下肿瘤模型,研究Combo-NP在体内的生物分布。接下来,在BALB/c裸鼠皮下OCM1肿瘤中评估了Combo-NP的抗肿瘤活性。最后通过H&E染色和末端脱氧核苷酸转移酶介导的dUTP缺口与标记法(TUNEL)检测了肿瘤组织的坏死和凋亡。H&E染色结果显示,经Combo-NP+L处理的小鼠肿瘤组织中出现较大的核碎裂、核溶解。同时,TUNEL检测提示,Combo-NP+L组小鼠肿瘤组织中绿色荧光强度明显高于其他组小鼠肿瘤组织。综上所述,Combo-NP+L对肿瘤生长的抑制作用最强。
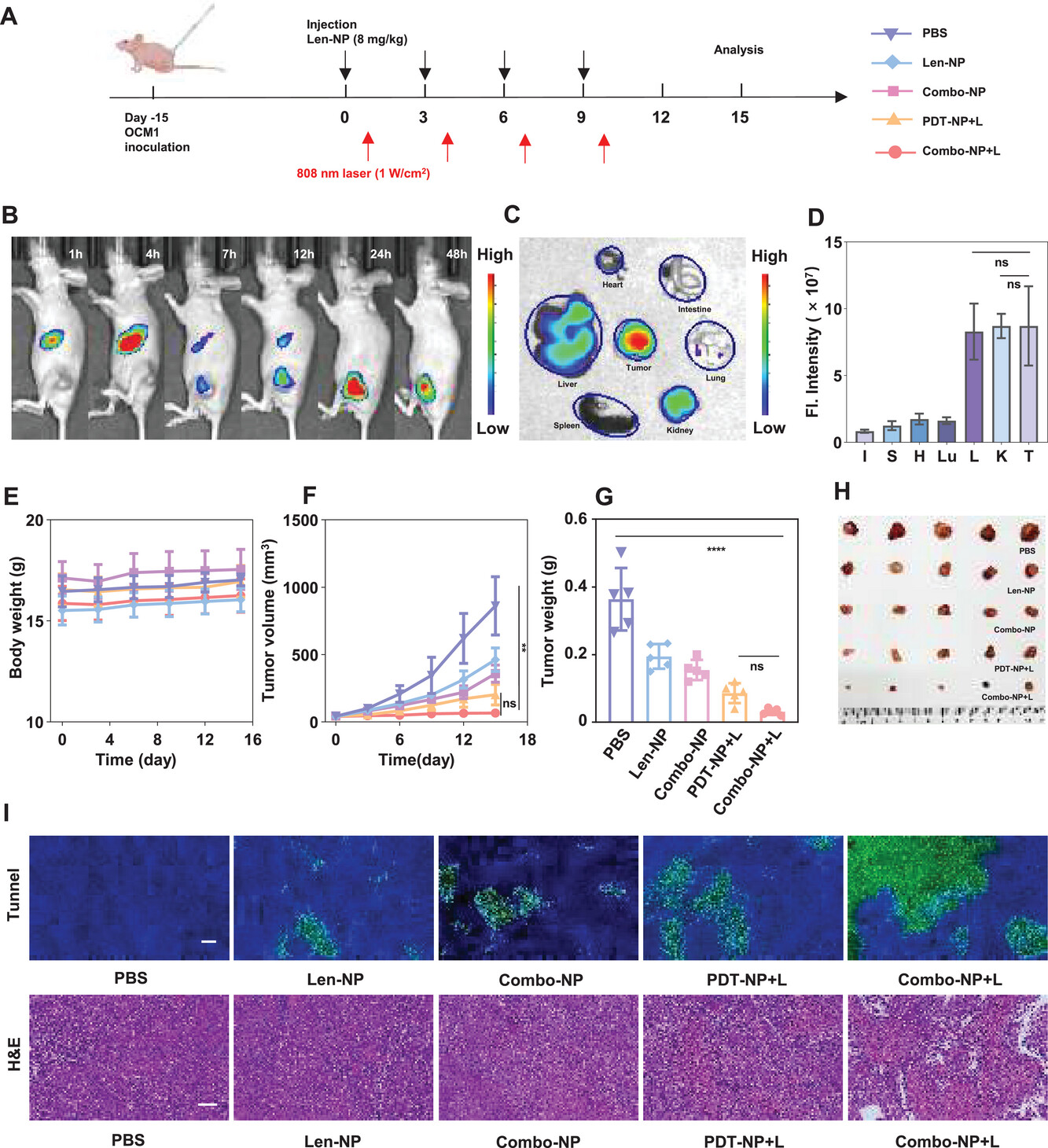
Combo-NP在OCM1荷瘤裸鼠模型中的生物分布和抗肿瘤作用
研究人员进一步研究了Combo-NP联合α-PD-L1 mAb是否能诱导全身抗肿瘤介导的远隔效应并抑制肿瘤转移。为了验证这一假设,首先,研究人员建立了一个双侧B16F10同基因模型来研究远端肿瘤的肿瘤生长和免疫特征。为进一步研究复方np +L+α-PD-L1的协同抗肿瘤作用机制,于第16天处死小鼠,采用流式细胞术(FCM)分析继发性(远处转移)肿瘤中的免疫细胞。最后,研究人员进一步探索了免疫抑制剂包括MDSCs和Tregs的比例,结果显示,与PBS相比,Combo-NP+L+α-PD-L1处理的小鼠的MDSCs和Tregs分别从13.2%下降到6.6%和15.6%下降到7.6%。结果表明,虽然其他治疗组小鼠肺内可见转移结节,但Combo-NP+L+α-PD-L1治疗组小鼠肺内未见转移结节。综上所述,Combo-NP+L可充分激活抗肿瘤免疫反应用于光动力-免疫治疗,并通过血管正常化和免疫调节改善免疫抑制的肿瘤微环境。进一步联合抗pd - l1单抗可激活更强的全身免疫活性,表现出更强的远隔效应,抑制肿瘤转移。
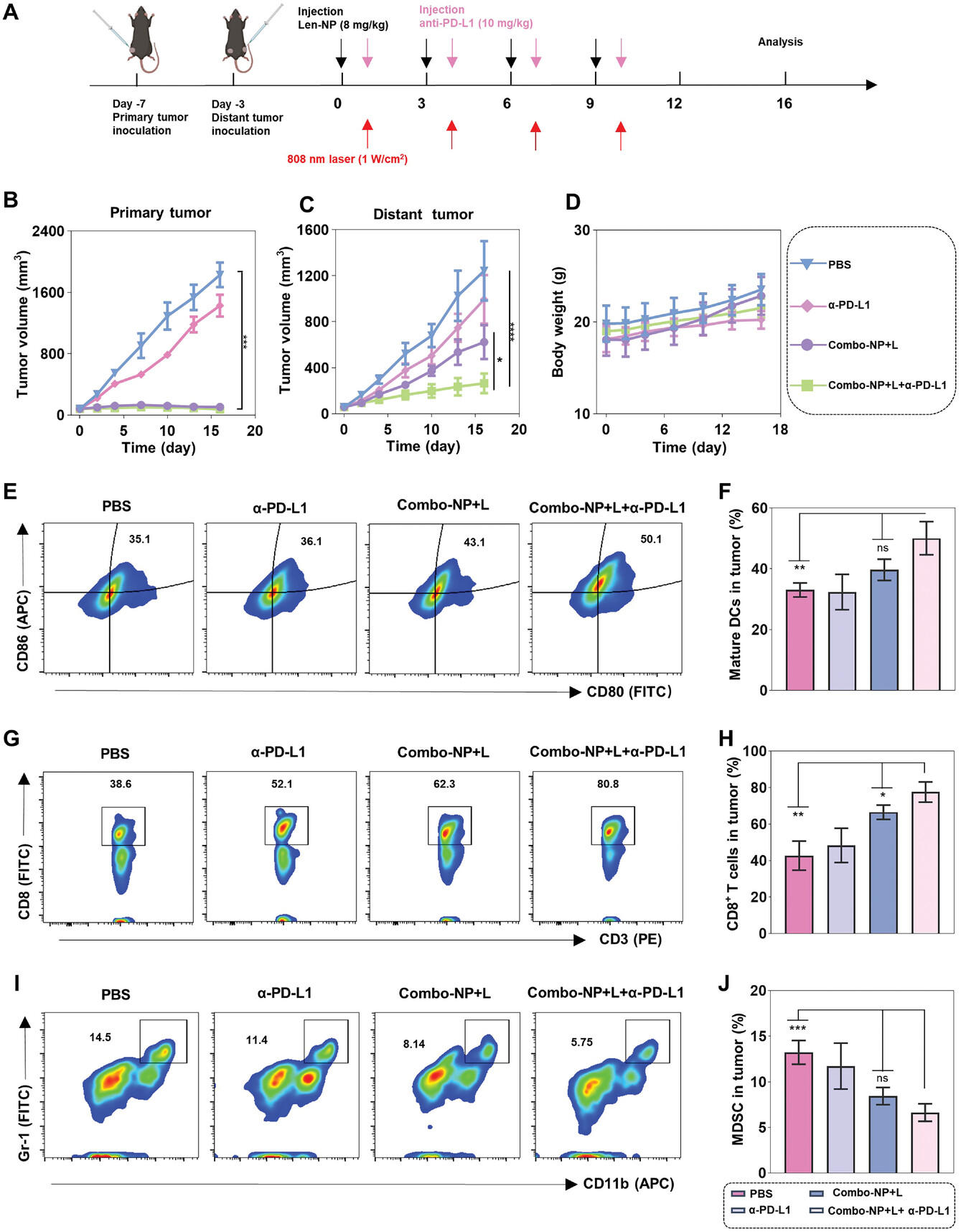
联合应用Combo-NP和α-PD-L1 mAb可诱导B16F10皮下肿瘤模型的全身抗肿瘤效应
研究结论
03
综上所述,Combo-NP+L为UM的治疗提供了一种新的、有前景的策略。它还可以作为一种潜在的免疫佐剂来提高抗pd - L1治疗的效率,从而为对抗UM和其他相关癌症提供一种新的治疗模式。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202206932
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发