【Adv. Sci.】安徽医科大学设计新型纳米颗粒 既可直接杀死癌细胞联合放疗又可预防肿瘤生长和肺转移
| 导读 | 导读:放射治疗(RT)是一种广泛应用于临床的癌症治疗方式,利用高能照射产生活性氧(ROS)和损伤DNA。然而,由于对肿瘤的DNA损伤不足并对正常组织产生的有害影响,其治疗效果受到限制。 |
9月8日,安徽医科大学研究人员在国际学术期刊《Advanced Science》上发表了题为“Multifunctional Au@AgBiS2 Nanoparticles as High-Efficiency Radiosensitizers to Induce Pyroptosis for Cancer Radioimmunotherapy”的研究论文。在该研究中,研究人员合理设计了一种核壳结构的金属-半导体(Au@AgBiS2纳米颗粒),可以作为焦亡诱导剂直接杀死癌细胞,并触发对4T1三阴性小鼠乳腺癌和转移的强大抗肿瘤免疫。金属-半导体复合材料可以增强大量活性氧的产生,同时对RT敏化造成DNA损伤。此外,Au@AgBiS2,一种焦亡诱导剂,联合RT具有显著的抗肿瘤免疫活性,可阻止肿瘤生长和肺转移。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202302141
研究背景
01
放射治疗(RT)是恶性肿瘤的一种重要治疗方式。大约70%的癌症患者在治疗过程中接受了放疗。放射治疗的主要特点是直接损伤DNA和通过水辐解间接产生活性氧(ROS),导致电离辐射(x射线/γ射线)诱导癌细胞凋亡。然而,由于肿瘤微环境(tumor microenvironment, TME)的复杂性和周围正常组织的不可预测的反应,完全消除肿瘤是极具挑战性的。此外,肿瘤可以接受的最大放射治疗剂量受到正常组织耐受能力的限制。另外,更高的辐射剂量往往是不切实际的,导致健康组织出现更多的不利影响。因此,临床放疗使用的剂量往往是肿瘤疗效和辐射损伤之间的权衡。增强放射敏感性的策略主要是根据辐射的物理化学特性和致敏机制,在低剂量条件下获得安全高效的放射增敏剂。最近,基于高原子序数(Z)元素的纳米材料,如Au、Ag、Bi和Gd以及一些半导体,通过有效地将更多的辐射能量沉积到肿瘤区域,已成为潜在的放射增敏剂。然而,理想的放射增敏剂具有良好的生物安全性和选择性肿瘤积累,降低了正常组织并发症的可能性。根据研究人员之前的研究,空心AgBiS2纳米球可以诱导肿瘤细胞特异性毒性,但不会对正常细胞产生任何毒性,表明其具有肿瘤靶向性和生物安全性。
值得注意的是,RT不仅直接和间接引起DNA和氧化损伤,还诱导肿瘤抗原产生,增强抗肿瘤免疫应答;这对于放疗诱导的肿瘤缓解至关重要。TME中肿瘤与基质细胞之间的强大免疫反应与x射线照射有关,通过放疗和免疫治疗的协同作用,可特异性地导致肿瘤细胞死亡。然而,当使用这种组合策略时,维持增强的免疫应答和长期免疫记忆具有挑战性。因此,迫切需要开发新的方法来提高放疗疗效并产生可持续的免疫记忆反应。研究发现表明,由过量ROS产生触发的细胞焦亡反过来触发强大的抗肿瘤免疫反应,并通过促进长期免疫记忆有效抑制肺转移。因此,它是一种新颖的概念,拓宽了肿瘤治疗策略的范围。
研究过程
02
在本研究中,研究人员利用硬模板结合多元醇的方法制备了一种金属-半导体核-壳纳米结构Au@AgBiS2,作为一种优良的放射增敏剂,具有良好的生物安全性,可以提高TME中的放疗效果,并诱导细胞焦亡,从而增强局部和全身抗肿瘤效应。在高能x射线照射下,Bi元素作为外壳,作为高原子序数沉积了更多的辐射能量,并释放出少量的Ag离子,会刺激免疫反应的产生。另一方面,作为内核的Au纳米棒保持了稳定的结构,并在肿瘤微环境中继续增敏放疗。放疗后高原子序数的存在导致大量ROS产生,同时诱导肿瘤细胞焦亡,触发强烈的免疫反应来治疗原发肿瘤,并有效预防肺转移。
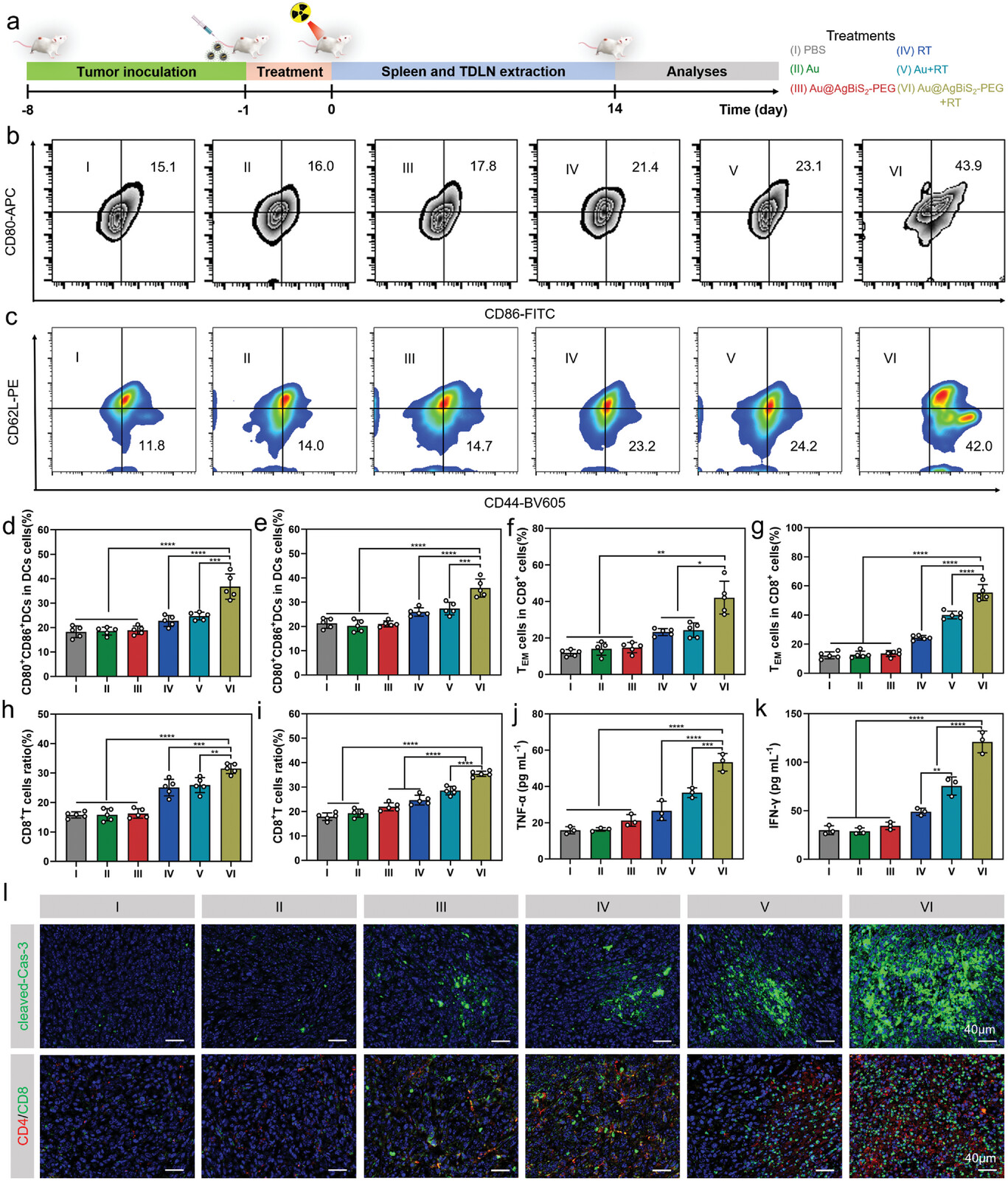
Au@AgBiS2联合放疗在4T1肿瘤模型中表现出良好的抗肿瘤反应
研究结论
03
本研究提出了一种利用中间层转换方法合理设计Au@AgBiS2-PEG核壳结构的方法。由于高Z元素的存在,得到的Au@AgBiS2-PEG核壳结构在辐照条件下表现出增强的DNA损伤。此外,Au@AgBiS2-PEG释放Ag离子促进电荷分离,导致辐照下ROS生成增加,并增强RT引起的DNA损伤,从而使癌细胞对RT敏感。研究人员还证明,Au@AgBiS2-PEG在辐照触发时,通过活化的胱天蛋白酶3裂解GSDME诱导焦亡,并在体外释放损伤相关的分子模式。在体内,Au@AgBiS2-PEG与RT联合使用可显著促进ROS的产生,引发强大的抗肿瘤免疫反应,有效防止肺部和全身转移,这凸显了Au@AgBiS2-PEG诱导热亡的强大能力。此外,研究人员的肿瘤治疗实验证实了Au@AgBiS2-PEG具有良好的生物相容性和生物安全性,以及其显著的抑制增殖和诱导细胞凋亡的能力。这项工作不仅为利用研究人员的合成方法制造金属-半导体混合体提供了一种新的策略,而且为放射致敏和RT触发的焦热介导的癌症免疫治疗提供了见解和灵感。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202302141
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发