重要进展!中南湘雅二/三医院揭示肺癌治疗新靶点!克服化疗耐药性
| 导读 | 肺癌是世界上最常见的恶性肿瘤之一,已成为我国城市人口恶性肿瘤死亡原因的第1位。非小细胞型肺癌包括鳞状细胞癌(鳞癌)、腺癌、大细胞癌,与小细胞癌相比其癌细胞生长分裂较慢,扩散转移相对较晚。 |
非小细胞肺癌(Non-small cell lung cancer, NSCLC)是最常见的癌症类型,也是癌症相关死亡的主要原因。化疗耐药是NSCLC患者治疗的主要障碍。
近日,中南大学湘雅二院和湘雅三院的研究人员在《communications biology》上发表题为“Skp2-mediated MLKL degradation confers cisplatin-resistant in non-small cell lung cancer cells”的研究文章。在本研究中,研究人员发现在人NSCLC组织和细胞系中,E3连接酶Skp2过表达,伴随坏死性凋亡相关调节因子MLKL的下调。敲低Skp2抑制了NSCLC细胞的活力、锚着非依赖性生长和体内肿瘤的发展。在NSCLC组织中,Skp2蛋白与MLKL呈负相关。此外,在顺铂耐药的NSCLC细胞中,Skp2表达增加,并伴有MLKL泛素化和降解的上调。因此,在体内外实验中,抑制Skp2可部分恢复MLKL,并使NSCLC细胞对顺铂敏感。机制上,Skp2在顺铂耐药的NSCLC细胞中相互作用并促进MLKL的泛素化降解。我们的结果证明了SKp2依赖的机制调节MLKL降解和顺铂耐药,提示靶向SKp2 -泛素化MLKL降解可能克服NSCLC化疗耐药。

https://www.nature.com/articles/s42003-023-05166-6
研究背景
01
非小细胞肺癌(Non-small cell lung cancer, NSCLC)包括肺腺癌(lung adenocarcinoma, LUAD)、肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)和大细胞癌三种主要组织学亚型,约占肺癌的80-85% ,是全球癌症死亡的主要原因。目前已在NSCLC患者中检测出几种可采取治疗措施的基因改变,如EGFR、ALK、ROS1、KRAS、c-MET、RET、NTRK、BRAF和HER2,这些改变可用于靶向治疗。然而,随着时间的推移,这一亚组患者不可避免地会发生对靶向治疗的耐药。靶向治疗用尽后,通常提供全身性化疗(如铂类化疗),联合或不联合免疫检查点抑制剂(ICIs)的免疫治疗,如治疗方案中的抗程序性细胞死亡蛋白配体1(抗PD- l1)、抗程序性细胞死亡蛋白1(抗PD -1)、抗细胞毒性T淋巴细胞相关蛋白4(抗CTLA -4)抗体。此外,NSCLC患者经常对铂类化合物(如顺铂和卡铂)耐药。因此,了解铂类化合物的潜在作用机制对于克服铂类化合物临床应用的障碍,最终治愈癌症是必要的。
顺铂是治疗包括nsclc在内的人类肿瘤最有效的化疗药物之一。不幸的是,许多患者在以顺铂为基础的治疗过程中产生了耐药性。在本研究中,我们建立了顺铂耐药的NSCLC细胞株,并研究了Skp2是否在NSCLC顺铂耐药中起关键作用。我们发现Skp2是泛素化MLKL的E3连接酶。SKp2调控的MLKL泛素化和降解至少部分参与了NSCLC细胞对顺铂的耐药。Skp2基因或药物失活可使顺铂耐药的NSCLC细胞对顺铂治疗再次增敏,这表明Skp2介导的MLKL泛素化是克服NSCLC化疗耐药的潜在治疗靶点。
研究进程
02
Skp2在人非小细胞肺癌中高表达,并与肺癌的致瘤性相关
我们首先通过蛋白质印迹法检测了Skp2在永生化的非肿瘤细胞HBE和MRC5以及一组人类NSCLC细胞系中的蛋白水平。结果显示,除了H460和H358细胞外,Skp2在几乎所有被检测的人NSCLC细胞系中均高表达。我们进一步测定了NSCLC组织和配对的癌旁组织中Skp2的水平。数据表明,与癌旁组织相比,Skp2在NSCLC组织中的表达显著增加。为了评估Skp2对NSCLC细胞增殖的影响,我们构建了稳定敲低Skp2的H1299、H23、H125和A549细胞系,并验证了转染后有效抑制Skp2表达的shRNA。与shGFP对照相比,敲低Skp2抑制了这些细胞系的细胞增殖和锚着非依赖性细胞生长。为了确定Skp2在NSCLC体内肿瘤发生中的作用,我们进行了裸鼠模型。我们发现,在H23异种移植模型中,抑制Skp2表达显著抑制肿瘤生长。这些结果表明,Skp2在NSCLC的肿瘤发生中起关键作用,在NSCLC细胞中敲低Skp2降低了肿瘤的发生特性。
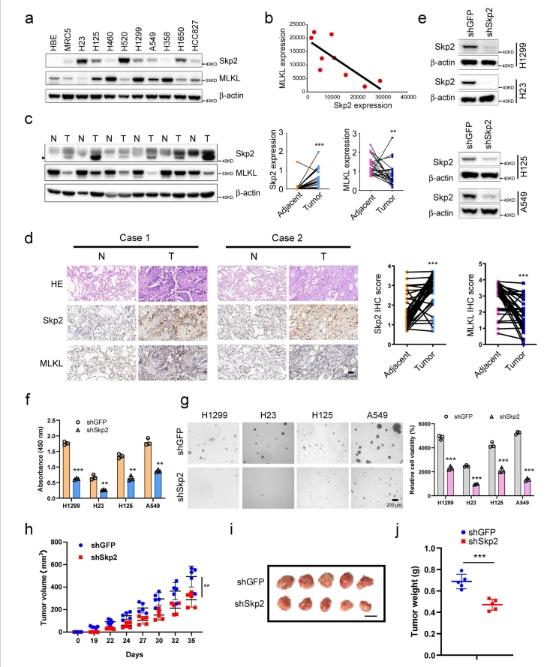
Skp2和MLKL在人非小细胞肺癌中的表达
研究成果
03
最近的研究表明,MLKL经历多种形式的降解性和非降解性泛素修饰,对程序性坏死产生不同的影响。MLKL在K51, K77, K172和K219被K63泛素化,在程序性坏死过程中需要ripk3诱导的磷酸化和泛素化。K219泛素化可保护小鼠免受程序性坏死诱导的皮肤损伤,并使细胞抵抗MLKL介导的细胞死亡。人类MLKL K230与小鼠MLKL残基K219相对应,已被报道为泛素化位点。此外,据报道,蛋白酶体抑制剂有助于MLKL的稳定,支持蛋白酶体介导的MLKL降解的潜在作用。有趣的是,坏死性凋亡特异性的多单泛素化在MLKL活化和寡聚化后发生。我们的结果表明,Skp2调节MLKL的稳定性,并通过蛋白酶体促进MLKL的泛素化和降解,提示Skp2参与了用K48泛素化修饰MLKL。虽然MLKL泛素化的分子机制和细胞后果开始显现,但许多基本问题仍需阐明,例如负责MLKL单泛素化或多泛素化的E3连接酶。
本研究将Skp2和坏死性凋亡复合体的关键成分MLKL与NSCLC的顺铂耐药联系起来。本研究为将Skp2作为一种克服治疗耐药的策略提供了概念验证,并为开发新型药物组合以增强以顺铂为基础的治疗NSCLC的疗效提供了理论依据。综上所述,我们证明了Skp2-MLKL轴可能通过抑制肿瘤细胞死亡参与NSCLC的顺铂耐药。我们的研究提供了令人信服的证据,用目前的化疗药物对Skp2进行药理学失活是治疗既往治疗失败的NSCLC患者的一种有前景的方法。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s42003-023-05166-6
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发