重磅!山东大学齐鲁医院在肿瘤放疗耐受和免疫微环境重塑领域取得新进展
| 导读 | 胶质瘤干细胞(GSCs)是胶质母细胞瘤(GBM)发展和治疗耐药性的关键因素。GSCs可分为间充质(MES)亚型和原神经(PN)亚型,这两种GSCs亚型在一定条件下可以发生相互转化。MES GSCs具有较高的恶性肿瘤和放射阻力,并且与免疫抑制微环境密切相关。长链非编码RNA(lncRNAs)在GBM中起广泛作用,而GSCs亚型的作用仍然未知。 |
近日,山东大学齐鲁医院神经外科李刚教授、郭兴副教授团队在国际权威杂志《Theranostics》发表了题为“SPI1-mediated MIR222HG transcription promotes proneural-to-mesenchymal transition of glioma stem cells and immunosuppressive polarization of macrophages” 的研究论文,研究首次揭示了宿主基因MIR222HG促进胶质母细胞瘤放疗耐受及免疫微环境抑制的新机制。

https://www.thno.org/v13p3310.htm
研究背景
GBM是最常见的颅内原发性恶性肿瘤,治疗耐药性高,预后效果差,即使接受规范的手术、术后放化疗等综合治疗,其中位生存期也不超过15个月。GBM难以根治的主要原因不仅是肿瘤难以切除干净,还与肿瘤的放疗耐受和免疫抑制性微环境密切相关。基于肿瘤基因表达谱的异质性研究发现GBM至少存在三种亚型,分别是前神经元型(Proneural, PN)、经典型(Classical, CL)和间充质型(Mesenchymal, MES)。相比预后较好、对放疗较为敏感的PN亚型,MES亚型的GBM病人表现出较差的预后和较强的放疗抵抗性。放射治疗一直是GBM治疗的主要手段,而驱动GBM放疗耐受的确切分子机制尚不清楚,GBM内部细胞的异质性和可塑性被认为是驱动治疗抗性和肿瘤复发的关键因素。
肿瘤微环境(TME)是肿瘤生长的基础,由免疫细胞、基质细胞、细胞外基质(ECM)、分泌分子和其他成分组成。TME与GBM的分子表型异质性密切相关,并影响GBM分子表型可塑性机制的调控。在GBM的TME中,肿瘤相关巨噬细胞(TAM)是最丰富的细胞群,占GBM TME中总细胞总数的50%,在免疫抑制TME的相互作用生态和GBM的恶性进展中起着重要作用。外泌体是直径为50-100nm的细胞外分泌囊泡,可以包封蛋白质、RNA和其他物质,以便在细胞之间转移。肿瘤细胞和巨噬细胞可以通过外泌体递送相互作用。我们之前的研究表明,sEVs,包括外泌体,可以从免疫抑制巨噬细胞转移到GSCs中以诱导PMT;然而,mGSCs是否也可以反向作用以诱导巨噬细胞免疫抑制仍有待探索。
非编码RNA,包括microRNA(miRNA)和长链非编码RNA(lncRNA),是一类不能编码蛋白质并在肿瘤中发挥重要作用的RNA。越来越多的研究表明,lncRNA表达谱可以反映GSCs的内在PN和MES亚型特征,但lncRNA是否参与GSCs中的PMT尚未得到探索。
研究进展
GBM患者从放疗中获得的益处很少,主要是由于mGSCs的放疗耐药性。在这里,我们进一步研究了MIR222HG介导的MES亚型是否协调GSC中放射性耐药性的获得。 GSC在放射治疗后表现出DNA损伤,G2 / M停滞和细胞凋亡。与pGSCs相比,mGSCs在放射治疗后表现出更少的细胞凋亡,G2 / M停滞和DNA损伤。此外,敲低mGSC中的MIR222HG增强了对放疗的反应。相反,pGSC中MIR222HG的高表达减弱了对放疗的反应。
在体内,敲低mGSC中的MIR222HG增强了携带mGSC的小鼠的放射治疗反应,减弱了肿瘤发生并延长了存活期。小鼠脑切片的HE染色显示,敲低MIR222HG联合放疗可显著降低肿瘤侵袭性。组织切片的TUNEL测定表明,敲低MIR222HG可增强体内mGSCs的凋亡。相比之下,植入高表达MIR222HG的pGSC的小鼠对放疗的反应降低,肿瘤生长更快,放疗后生存期更短。HE染色显示植入高表达MIR222HG并接受放疗的pGSCs组的肿瘤侵袭性显著增加。TUNEL 测定表明,MIR222HG 的高表达降低了体内肿瘤的凋亡水平。综上所述,MIR222HG增强了mGSCs在体内和体外的耐辐射性。
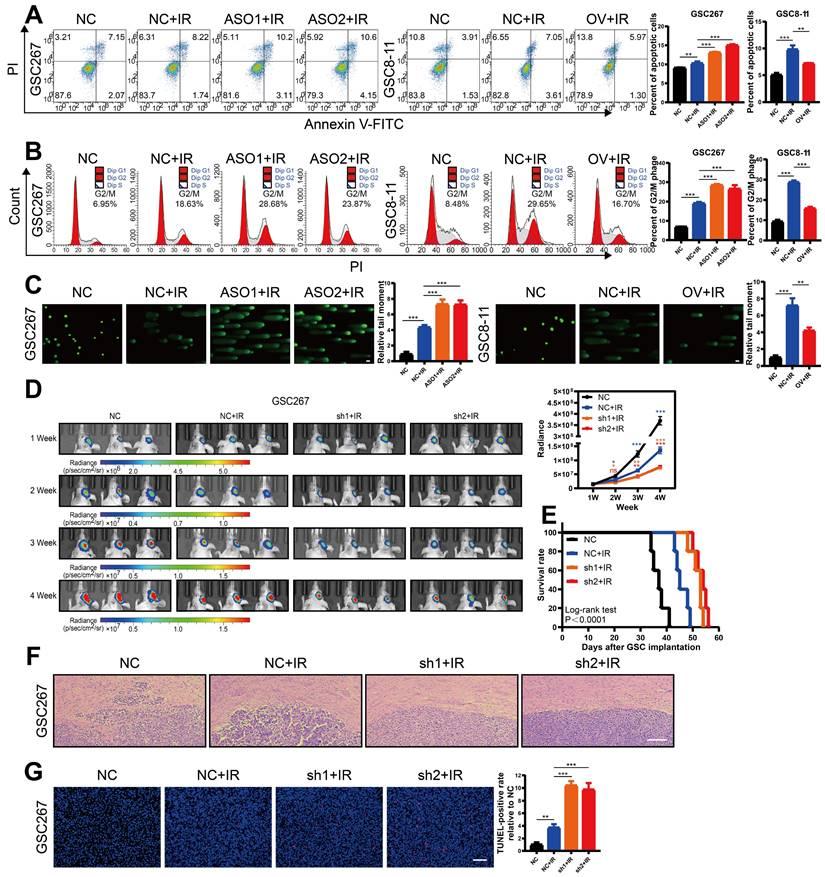
MIR222HG表达与mGSC中的放射耐药性相关
研究结果
在这项研究中,研究发现MIR222HG可由SPI1诱导,在MES GBM组织中高表达。在功能上,我们证明了MIR222HG在体内和体外促进GSC中的MES转变和辐射耐药性。在机制上,MIR222HG可以与YWHAE / HDAC5复合物结合,通过H4脱乙酰促进GSC的MES转变。此外,共转录的miR221和miR222可以通过外泌体递送到巨噬细胞靶向SOCS3,引起免疫抑制极化。最后,PLX-4720灵敏度与SPI1表达相关,并作用于MES GSC以增强放射敏感性。
总之,本研究表明,靶向SPI1阻断MIR222HG簇的转录有助于降低GBM的放射阻力并对抗免疫抑制微环境。PLX-4720是一种潜在的GBM药物和放射增敏剂。这一研究成果为胶质母细胞瘤提供了新的放化疗联合干预策略(转化医学网360zhyx.com)。
参考资料:
https://www.qiluhospital.com/show-25-31230-1.html
https://www.thno.org/v13p3310.htm
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发