【Immunity】全面唤醒潜在的肿瘤杀手,免疫治疗能否再下一城?
| 导读 | 人们将大部分关注点都放在了CD8+CTL细胞反应,对CD4+T细胞的作用多有忽视。 |
细胞免疫是机体抗肿瘤免疫的主要方式,癌症患者体内天然存在着能够对恶性肿瘤细胞进行识别、攻击和杀伤的癌相关CD8+记忆T细胞,它们具有对少量肿瘤细胞产生快速免疫应答和持续长期发挥抗癌作用的优点。因此人们将大部分关注点都放在了CD8+CTL细胞反应,对CD4+T细胞的作用多有忽视。但多种研究已显示CD4+T细胞是亦可直接杀伤肿瘤细胞,只是唤醒机制不明,作用受限。
近日,英国伦敦大学的研究人员发现了一种激活CD4+T细胞肿瘤杀伤功能的新机制,最大限度地发挥了CD4+T细胞的功能,为肿瘤免疫治疗的发展提供了新思路。

肿瘤是机体正常细胞恶变的产物,其特点是不断增殖并在体内转移。CD4+T细胞是T细胞的一种,是人体免疫系统的指挥中枢,负责消灭和控制多种的感染,对抗入侵的病菌。在肿瘤免疫中,CD4+T细胞启动后可以通过多种机制激活CD8+T细胞,使其分化为细胞毒性T淋巴细胞(CTL),同时维持并加强CTL的抗肿瘤反应。
有研究证实在CD8+T细胞缺乏的情况下,CD4+T细胞还可以通过IFN-γ机制直接杀死肿瘤细胞,而且这种作用比丝毫不逊色于同等数量的CD8+T细胞。但是,CD4+T细胞的直接肿瘤杀伤作用相较于CD8+T细胞而言显得微不足道。为什么呢?因为大多数时候CD4+T细胞在抗肿瘤反应中皆处于辅助地位,直接肿瘤杀伤作用并未被激发。若能最大限度地激活CD4+T细胞的直接肿瘤杀伤作用,相信免疫系统对肿瘤的封锁会更加牢不可破。
谁会是那个“闹钟”呢?
研究人员发现免疫系统的另一个重要成分B淋巴细胞诱导成熟蛋白(Blimp-1)正是“闹钟”的不二之选。Blimp-1是由正性调控区域(PRDM)1基因编码的蛋白,最初因其可以促进B淋巴细胞转变为抗体分泌细胞而引起相关研究人员的重视。后来,多种研究证实Blimp-1不仅局限于B细胞和浆细胞,还可参与调控免疫系统中髓系细胞、自然杀伤细胞和巨噬细胞的发育与功能。此外,Blimp-1对T细胞的增殖分化和免疫自稳亦发挥着至关重要的作用。
白细胞介素-2(IL-2)是CD4 + T细胞获得细胞毒性的关键。IL-2是免疫系统中的一类细胞生长因子,能调控免疫系统中白血球的细胞活性,促进Th0和CTL的增殖,也参与抗体反应、造血和肿瘤监视。而IL-2/IL-2R信号可作为一种调节分子,能整合CD4+T细胞在免疫应答中的多种信号,从而将T细胞打造成一种更为成熟的形式,即细胞毒性CD4+T细胞。那么IL-2从何而来呢?
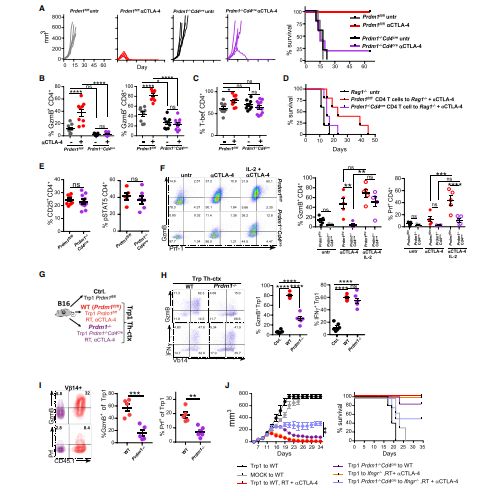
IL-2以Blimp-1依赖性方式控制CD4 + T细胞的毒性分化
研究人员发现,Blimp-1在CD4+T细胞中的高表达就可以导致IL-2大量分泌,诱导CD4+T细胞分化为细胞毒性T细胞,进而使得CD4+T细胞成为杀伤肿瘤的一线战士。
实验结果显示,IL-2可以Blimp-1依赖性方式控制CD4 + T细胞的毒性分化,Blimp-1的大量表达可全方位激活CD4+T细胞的细胞毒性,从而深度挖掘CD4+T细胞对肿瘤细胞的杀伤作用,实现了CD4+T细胞作用的最大化发挥。也就是说,订好Blimp-1这个“闹钟”,就能及时唤醒CD4+T细胞参与直接杀伤肿瘤的战争中,最大限度地提高免疫系统的肿瘤杀伤功能,让肿瘤无处可逃!
这项研究为CD4+T细胞对肿瘤的直接杀伤作用提供了证据和新的研究方向,拓宽了人们对细胞分化调节剂的认知,有助于研究人员更好地了解免疫系统的复杂性,并全方面利用免疫系统对抗癌症,也为免疫治疗的潜力带来更多的证据与方向。
参考文献:
Anna Śledzińska,et al.Regulatory T Cells Restrain Interleukin-2- and Blimp-1-Dependent Acquisition of Cytotoxic Function by CD4+ T Cells.Immunity(2020)

招聘兼职医学编辑
岗位职责:
1. 关注生物医药业内动态,对最新研究和热点事件快速反应,并产生有质量的内容;
2. 有强烈的责任心和良好的团队合作精神,诚信守时,工作认真细致。
岗位要求:
1. 生物医药及相关专业硕士及以上学历;
2. 英语笔译能力佳,有医学翻译经验、SCI论文者加分;
3. 有一定的翻译速度并有工作经验者优先;
4. 有强烈的责任心和良好的团队合作精神,诚信守时,工作认真细致;
5. 能承受一定工作压力。
联系方式:
朱老师
邮箱:zhuling@360zhyx.com
手机:18501604432(微信同号)
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录

还没有人评论,赶快抢个沙发