Ibrance国内重磅获批上市,看看这种药怎么用?
| 导读 | 全球首个细胞周期蛋白依赖性激酶CDK4/6抑制剂爱博新® IBRANCE®(哌柏西利, palbociclib)已于7月31日获得中国国家药品监督管理局批准。批准爱博新®适用于治疗激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性的局部晚期或转移性乳腺癌,应与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗。 |
作用机理及适应症
周期蛋白依赖性激酶4/6(cyclin-dependent kinase4/6,CDK4/6)是一类丝/苏氨酸激酶,与细胞周期素D(cyclinD)结合,调节细胞由G1期向S期转换。在很多肿瘤中,都存在“cyclinD-CDK4/6-INK4-Rb通路”异常。这条通路的改变,加速了G1期进程,使得肿瘤细胞增殖加快而获得生存优势。因此,对其干预成为一种治疗策略,CDK4/6也因此成为抗肿瘤的靶点之一。
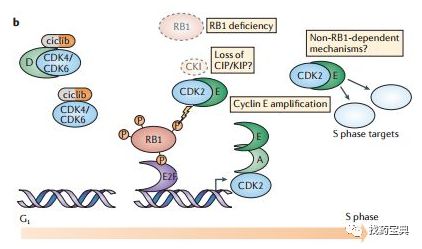
Palbociclib是FDA批准的首个CDK4/6抑制剂,该药在乳腺癌开展PALOMA1/2/3一系列临床研究。基于II期研究PALOMA-1,2015年2月3日FDA加速批准了palbociclib联合来曲唑用于绝经后 ER+/HER2-晚期乳腺癌的一线治疗。2016年2月19日FDA根据III期PALOMA-3研究批准了IBRANCE联合氟维司群用于既往内分泌治疗失败的HR+/HER2- 绝经后晚期乳腺癌。
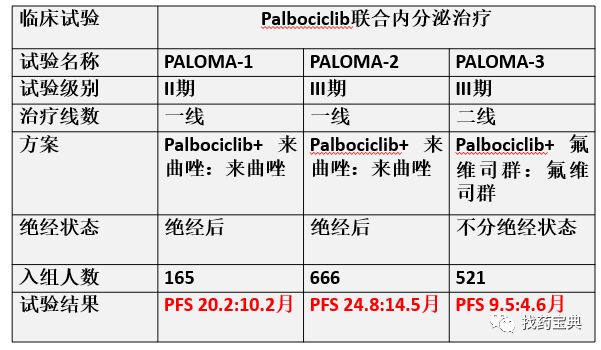
由表格中的PFS可以看到,对于ER、PR+的乳腺癌患者,可以在(1)传统内分泌药物如来曲唑、他莫昔芬耐药后加上Ibrance使用,比既往二线方案氟维司群PFS翻倍;(2)如果经济可以,患者可以直接在内分泌初治时就直接采用Ibrance+内分泌药物,可获得PFS 24.8个月的无进展期。无论内分泌一线二线,都将内分泌药物的维持时间明显延长,此药的国内上市确实为内分泌型乳腺癌患者带来新的治疗希望。
同类型竞品药物
CDK4/6靶点催生了一系列的产业链竞品,目前,FDA已批准3个CDK4/6抑制剂药物上市,第一个上市药物就是刚提及的辉瑞公司的Palbociclib(Ibrance);第二个上市药物是诺华公司的Ribociclib(Kisqali),第三个上市药物是礼来公司的Abemaciclib(Verzenio)。
后面两种药物目前获批的适应症也分别都在乳腺上。2017年03月13日Kisqali(前称LEE011)获FDA批准与芳香酶抑制剂联用可作为一线用药治疗HR阳性/ HER2阴性绝经后妇女晚期转移乳腺癌。2018年2月26日,FDA批准abemaciclib(VERZENIO™,礼来)与芳香化酶抑制剂联合应用于绝经后激素受体(HR)阳性HER2阴性晚期或转移性乳腺癌。三种药物在乳腺癌的使用方大及疗效上不分伯仲。也证实了该类药物在乳腺癌的使用价值。
但是,CDK4/6抑制剂只能用于乳腺癌吗?它的上市只能用在乳腺癌吗?答案是大写的NO。下面小编就给大家展示一下CDK4/6抑制剂在肺癌的多种使用。
肺癌
Palbociclib治疗肺癌
1.Palbociclib联合MEK抑制剂治疗KRAS突变肺癌I期试验:DCR为72%
2017年ACCR年会中表明,palbociclib和PD-0325901(一种MEK抑制剂)可以在K-RAS突变的NSCLC中显著提升患者的PFS。
Palbociclib是细胞周期蛋白依赖性激酶CDK4抑制剂;PD-0325901是MEK的实验性抑制剂。MEK和CDK4/6位于RAS癌基因的“下游”,并且比RAS本身更容易被靶向。
帕博西尼联合PD-0325901(一种MEK抑制剂)的一期临床试验,纳入25例KRAS突变实体瘤,其中17例晚期NSCLC。总有效率4%,疾病控制率72%。常见不良反应为白细胞减少(72%)、贫血(72%)、血小板减少(72%)、中性粒细胞减少(64%)、痤疮样皮疹(64%)、腹泻(52%)、乏力(44%)等。
最大耐受剂量确定为帕博西尼125mg每天一次和PD-0325901 8mg每天二次。
2.Palbociclib治疗肺癌II期试验:DCR为44%
纳入的患者为既往至少接受过1线以上的铂类为基础的化疗的患者,并且需要具有可及的肿瘤组织,以检测是否CDK4或CCND1,CCND2和CCND3扩增。
研究最终入组了53名患者,17例接受多西他赛治疗,36名患者接受palbociclib治疗。
83%的患者有CCND1扩增,13%患者有CCND2扩增,9%患者有CCND3扩增,6%患者有CDK4扩增。5名palbociclib患者不能评估。在可评估的32名患者中,仅可见2名PR患者(6.25%)。疾病控制率为44%,中位PFS为1.7个月。
1名PR的患者缓解持续时间为7.7个月。4名患者发生4度不良反应,13名患者出现3度不良反应。
Abemaciclib 治疗肺癌
Abemaciclib是CDK4/6抑制剂在K-RAS突变肿瘤临床研究中发展最远的一个。它是一种小分子CDK4/6抑制剂,对CDK4有更好的选择性。Abemaciclib可以通过组织磷酸化、使视网膜母细胞瘤肿瘤抑制蛋白功能性失活,达到一致细胞周期进展的作用。
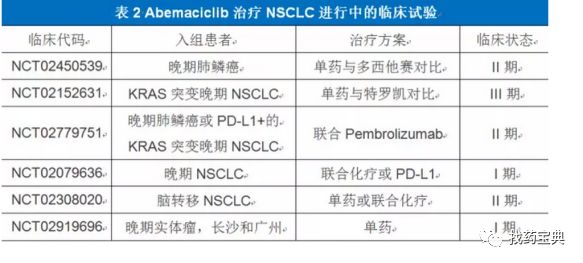
1.Abemaciclib 治疗肺癌I期试验:DCR为55%
Abemaciclib的Ⅰ期临床试验(NCT01394016)中,NSCLC 68例,其中Kras突变型患者29例。仅1例部分缓解,疾病控制率55%,野生型为39%,中位无进展生存期2.8月。这些结果说明,K-RAS突变较野生型NSCLC患者对abemaciclib更为敏感。
3级或以上不良反应主要是白细胞减少(10%)、中性粒细胞减少(10%)、腹泻(5%)和血小板减少(7%)等。
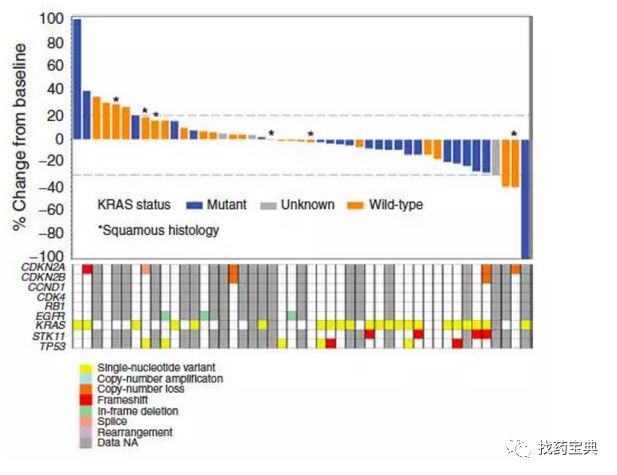
2.Abemaciclib 治疗肺癌III期试验:DCR为54.4%
JUNIPER三期临床试验,453例KRAS突变晚期NSCLC按3:2比例随机分入Abemaciclib(200mg 每天二次)组或厄洛替尼组,主要研究终点OS未能达到,但PFS和ORR有改善,具体数据在2018 ASCO上公布。
OS: Abemaciclib组为7.4个月,厄洛替尼组7.8个月
PFS:Abemaciclib组为3.6个月,厄洛替尼组1.9个月
ORR:Abemaciclib组为8.9%,厄洛替尼组为2.7%
DCR:Abemaciclib组为54.4%,厄洛替尼组为31.7%
在先前治疗的具有KRAS突变的IV期NSCLC患者中,abemaciclib没有改善OS,但与厄洛替尼相比,PFS和ORR显示出改善。 基于abemaciclib作用机制的进一步分子亚组分析正在进行中。
3.Abemaciclib 治疗肺鳞癌:DCR为50.9%
在1期研究中,abemaciclib在患有晚期和/或转移性NSCLC的患者中显示出活性。 这项2期研究评估了abemaciclib与多西紫杉醇对先前用铂类化疗治疗的IV期sqNSCLC患者的安全性和有效性。
159例患者随机分为abemaciclib(N = 106)和多西紫杉醇(N = 53)。主要研究终点是PFS。 关键的次要终点是ORR,DCR,OS和安全性。
PFS:abemaciclib,中位PFS为2.5m,多西紫杉醇为4.2m
ORR:abemaciclib的ORR为2.8%,多西紫杉醇的ORR为20.8%。
DCR(CR + PR + SD):对于abemaciclib治疗组,DCR为50.9%,多西紫杉醇治疗组为64.2%。
OS:abemaciclib的中位OS为7.0 m,多西紫杉醇为12.4 m。
在这项2期研究中,与多西紫杉醇相比,单药abemaciclib 200 mg并未改善PFS; 在任何给定时间点疾病进展/死亡的瞬时发生率更高。
其他CDK4/6抑制剂治疗肺癌
1.CDK4/6抑制剂Trilaciclib (G1T28) + EP化疗(小细胞肺癌):ORR为66.7%
Trilaciclib 是美国生物制药公司G1 Therapeutics研发的一款短效 CDK4/ 6 抑制剂,用于保护化疗过程中造血的干细胞和免疫系统功能的损伤,通俗点是保护骨髓功能。
2017年ASCO GI大会上 Therapeutics公布了Triliciclib联合EP一线治疗广泛期SCLC orr达到88%的惊人数据。
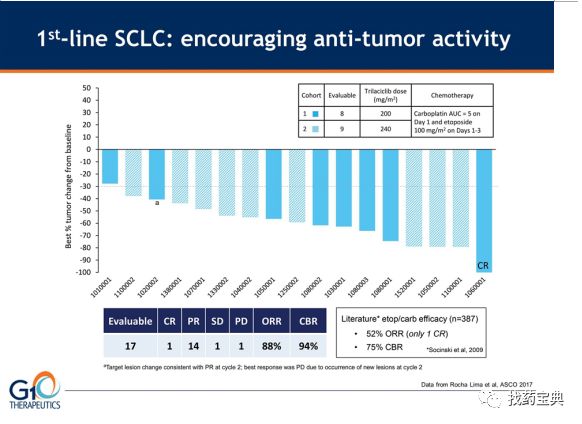
II期双盲实验,Triciclib对比安慰剂,招募了77例初治的确诊为广泛期SCLC患者,按照 1:1 随机分配,75 人在标准剂量的依托泊苷和卡铂 (EP) 化疗前接受了 trilaciclib 或安慰剂静脉滴注。
IIa期统计数据表明,相较安慰剂而言,trilaciclib 可以减少化疗引起的骨髓抑制相关事件的发生。并且Trilaciclib对入组患者而言耐受性良好,没有3/4级接受 Trilaciclib 治疗相关的紧急不良事件报告。相较安慰剂组,Trilaciclib组患者出现了较低地3级贫血、红细胞输注和3级血小板发热的良好趋势,两组均无4级贫血或血小板减少。
除了显示骨髓获益外,与安慰剂相比,Triaciclib 在总缓解率 (ORR)、反应持续时间(DOR) 和无进展生存期 (PFS) 方面表现出较好的趋势,OS数据还未完成:
ORR对比:Trilaciclib 66.7%, 安慰剂 62.2% (p=0.6759);
中位 DOR:Trilaciclib 5.7 个月, 安慰剂 4.3 个月 (p=0.1449);
中位PFS:Trilaciclib 6.2 个月, 安慰剂 5.0 个月 (HR 0.6, p=0.06)。
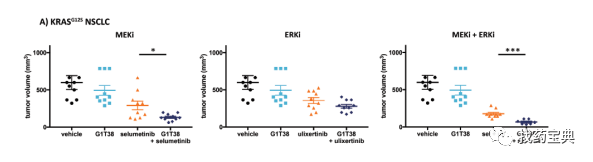
2.G1T38克服TKI原发耐药
G1T38是由G1 therapeutics开发的可口服的CDK4/6抑制剂,并且与其他CDK4/6抑制剂相比有可能成为“best-in-class”。目前正在许多不同的癌症如乳腺癌、前列腺癌、结肠癌、肺癌和脑癌,以及各种血液恶性肿瘤中研究与其他治疗药物联用的治疗效果。在2016年4月的美国癌症研究协会(AACR)年会上提供的临床前研究数据表明,G1T38比其他临床阶段CDK4/6抑制剂具有更好的安全性和耐受性以及更小的骨髓毒性等优势。
G1T38与TKI药剂联合治疗NSCLC靶向驱动突变显着增强疗效。2018AACR大会上报道了
G1T38的添加能够克服EGFRmut NSCLC模型中对单一药物EGFRi治疗的原发性和继发性耐药问题
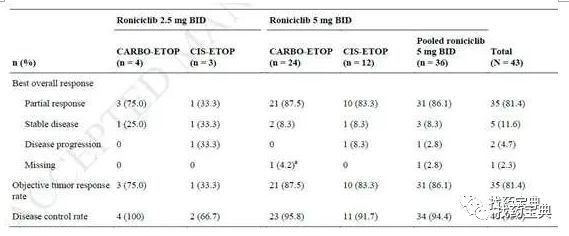
3.Ib/II期研究:Roniciclib联合化疗治疗初治广泛期SCLC患者,ORR为81.4%。
研究共纳入43例初治的广泛期小细胞肺癌患者,接受Roniciclib(2.5mg、5mg bid)联合依托泊苷+顺铂或依托泊苷+卡铂梯度剂量治疗。结果显示:ORR为81.4%,均为PR患者。SD为11.6%。DCR为93%。中位OS为12.6个月。
4.Roniciclib联合顺铂/依托泊苷一线治疗广泛期小细胞肺癌的II期试验
Roniciclib(BAY1000394)是一种新型广谱CDK抑制剂,具有强效的抗增殖活性。 此前已有研究表明roniciclib能抑制肿瘤细胞中的其CDK 1,2,3和4以及CDK 7和9。广泛期小细胞肺癌预后很差,这项临床试验评估roniciclib(口服CDK抑制剂)联合标准一线化疗方案治疗广泛期小细胞肺癌的疗效,未接受过化疗的小细胞肺癌患者1:1分配为两组,一组接受5mg roniciclib(R)一日两次口服,口服3日停药4日,一组进行安慰剂治疗,两组患者均同时接受标准化疗(依托泊苷联合顺铂或卡铂),化疗每21天为一个周期,共重复6周期,化疗后继续接受roniciclib或安慰剂单药治疗。结果总数为140例患者入组该实验,roniciclib及安慰剂组各70例。结果显示R药物联合化疗组与安慰剂联合化疗组相比,中位OS 10.7个月vs10.7个月。结论对于广泛期小细胞肺癌的患者在接受一线铂类为基础的化疗同时添加roniciclib治疗并不能提高疗效而仅仅增加毒副作用。
CDK4/6抑制剂不单是阻断了实体瘤的细胞周期,同时在免疫增强方面有一些效应,CDK4/6联合PD-1单抗也开展了临床研究。而且,除了乳腺癌和肺癌,CDK4/6抑制剂也在多种肿瘤中进行临床试验,如黑色素瘤等。该类药物上市后,大家根据以上所讲善加使用。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发