【文献】 新一代测序技术(NGS) 的十年之旅
| 导读 |
基因测序从一开始的可望不可即到如今走进寻常百姓家,其背后是测序公司和科研人员们孜孜不倦的努力,推动了整个测序行业不断向前发展,从目前的测序一哥illumina,再到华大智造GISEQ,以及业界新秀Nanopore。下面是Nature Reviews Genetics 的一篇综述,盘点近十年来测序技术的发展 |

标题:Coming of age: ten years of next-generation sequencing technologies
期刊:Nature Reviews Genetics
影响因子:40.2820
出版日期:2016 May 17
文献摘要

人类基因组计划(HGP)
自2003年完成人类基因组计划以来,基因组测序技术取得了非凡的进展,导致每兆碱基测序成本的降低,以及测序基因组数量和多样性的提升,进一步揭示了基因组结构的复杂性。这些测序技术为研究人员和临床医生提供了更多深入研究基因组的工具,从而加深了解基因组序列变异如何成为表型和疾病的机制。本篇综述罗列了NGS中所使用的各种技术方法,以及在该领域的最新进展,讨论了每种方法的细节及其优点和缺点。并探讨了该领域中的各种新兴应用及其展望。
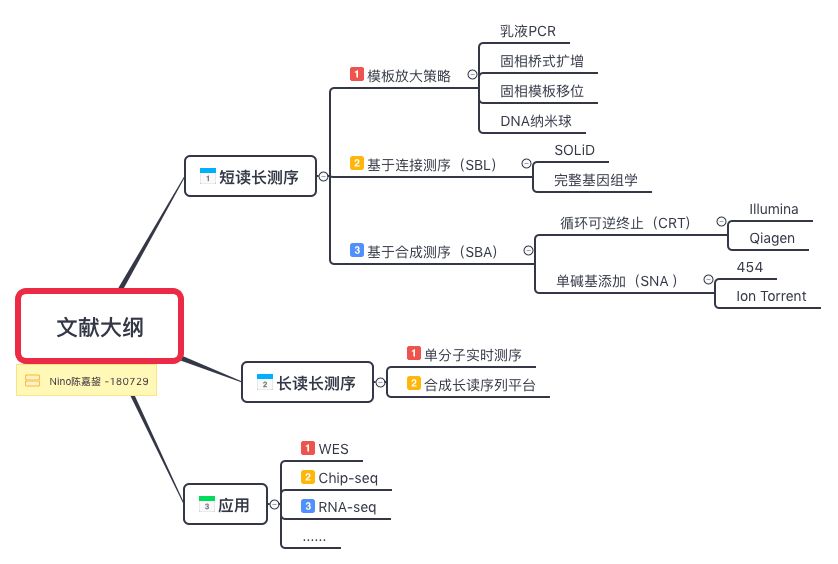
新一代测序(NGS)技术有两种主要类型:短读长测序和长读长测序。短读序列方法提供低成本,高准确度的数据,对于群体水平研究和临床变异发现非常有用。相比之下,长读取方法提供的读取长度适合于从头基因组装配应用和全长同种型测序。
文献大纲 思维导图
1。起步
短读序列方法分为两大类:连接测序(SBL)和合成测序(SBS)。在连接测序方法中,与荧光基团结合的探针序列与DNA片段杂交,并与相邻的寡核苷酸连接以进行成像。荧光基团的光谱表明与探针内特定位置互补的一个或多个碱基的类型。在合成测序方法中,使用聚合酶,并且诸如荧光基团或离子浓度变化的信号识别核苷酸在延伸链中的掺入。
①模板放大策略
在大多数方法中,DNA在固体表面上克隆扩增,在有限的区域中产生数千个相同的DNA片段拷贝。一方面有助于放大信号,确保信号可以与背景噪声区分开来;另一方面有助于从而形成彼此独立的反应中心,测序平台可以同时从数百万个反应中心收集信息,从而对数百万个DNA分子进行并行测序。有几种不同的策略用于产生克隆模板群:基于珠子,固态支持物以及DNA纳米球。
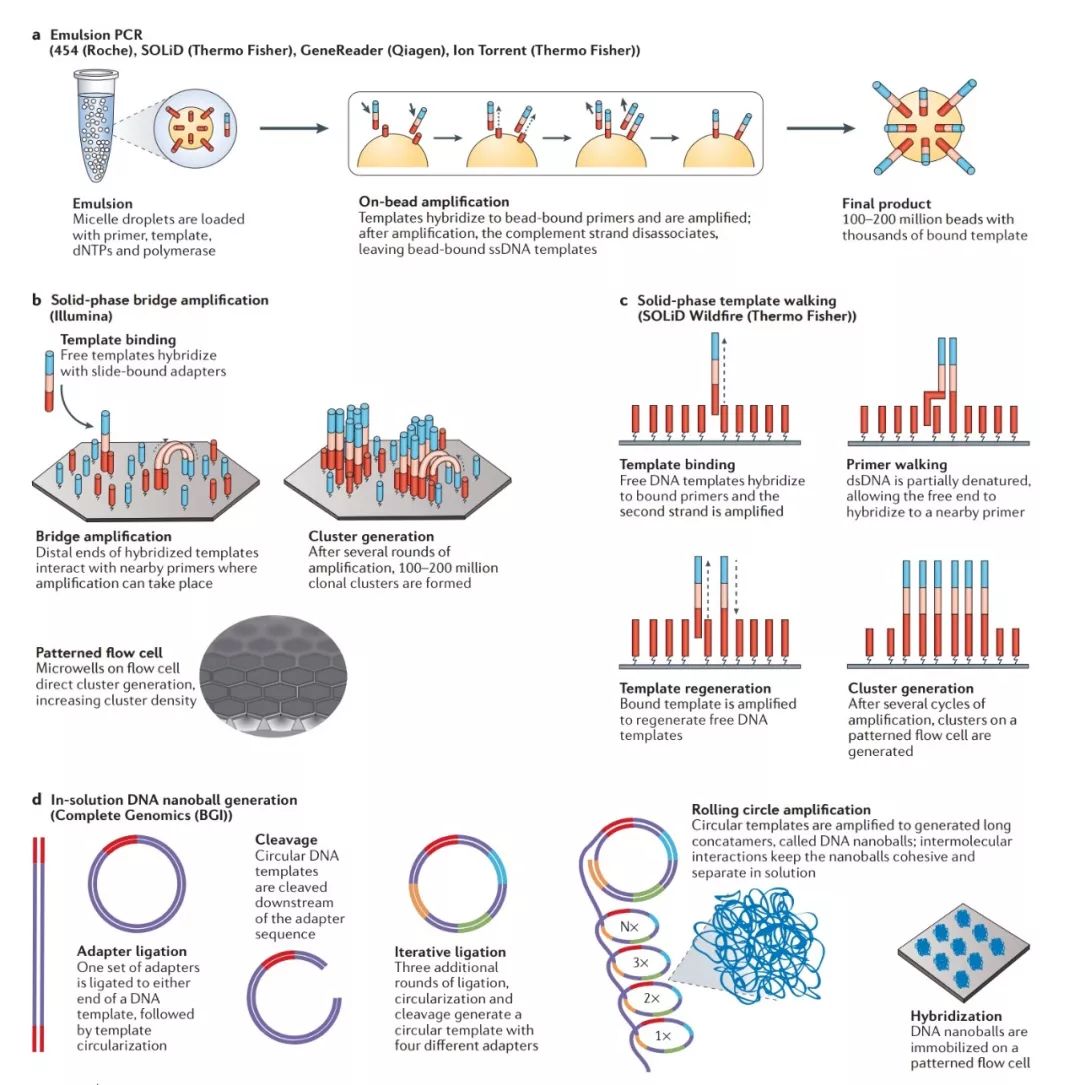
a | 油滴 PCR(454,SOLiD,Ion Torrent)
在油滴PCR中,将片段化的DNA模板连接到接头序列上,并将其与覆盖有互补接头,dNTP,引物和DNA聚合酶的珠子一起混合。在乳胶内进行PCR扩增,使每个珠子表面覆盖有数千拷贝的相同DNA序列。
b | 固相桥式 PCR 扩增(illumina)
在固相桥式扩增中,将片段化的DNA连接到接头序列上,并与固定在固体支持物(如流动池)上的引物结合。其自由端可以与附近的其他引物相互作用,形成桥式结构。 从固定的引物PCR扩增产生第二条链,并除去未结合的DNA。
c | 固相模板步行扩增(SOLiD)
在固相模板步行中,将片段化的DNA模板连接到衔接子上并与附着于固体支持物的互补引物结合。 进行PCR产生第二链。随后双链 DNA被部分变性,原始 DNA模板的自由端移动并与另一个附近的引物序列结合。反向引物再生DNA模板,经过几轮扩增循环,在流动池中形成扩增簇。
d | DNA纳米球扩增(Complete Genomics)
在DNA纳米球中,DNA片段化并与四个接头序列中的第一个相连接。用II型核酸内切酶扩增,环化和切割模板。添加第二组接头序列,然后进行扩增,环化和切割。对剩余的两个接头序列重复该过程。最终产品是带有四个接头序列的圆形模板,每个接头序列由模板序列分开。文库分子经历滚环扩增步骤,产生大量称为DNA纳米球的多联体,然后将其沉积在流动池上。
②基于连接测序(SBL)
基本上,SBL方法涉及标记探针和锚定序列与DNA链的杂交和连接。探针编码一个或两个已知碱基(单碱基编码探针或双碱基编码探针)和一系列简并或通用碱基,驱动探针和模板之间的互补结合,而锚片段编码已知与衔接子序列互补的序列,并提供起始连接的位点连接后,对模板进行成像,并鉴定探针中的已知碱基。在完全去除锚 - 探针复合物或通过切割去除荧光基团并再生连接位点之后开始新的循环。
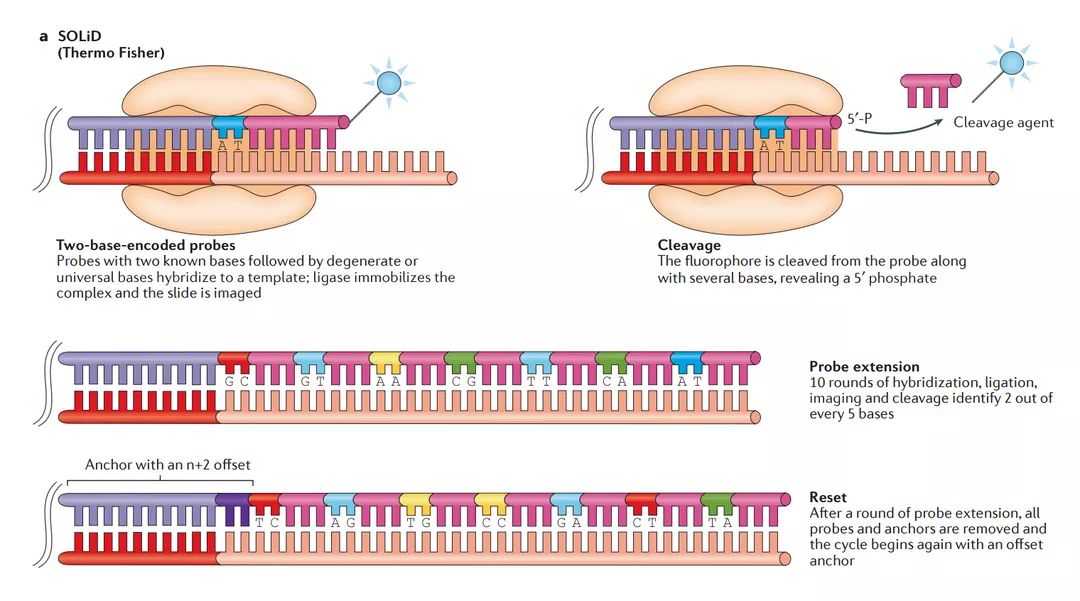
a | SOLiD测序
在载玻片上产生簇或珠沉积后,通过连接对片段进行测序。其中荧光团标记的双碱基编码的探针(深蓝色),其由第一和第二位置中的已知核苷酸组成,然后是简并或通用碱基(粉红色)被添加到DNA文库中。将双碱基探针连接到与接头序列(红色)互补的锚定序列(浅紫色)上,并对载玻片成像以鉴定每个片段中的前两个碱基。未延伸的链被无标记的探针或磷酸酶所覆盖,以维持循环同步。最后,末端简并碱基和荧光团从探针上切除,留下5bp的延伸片段。该过程重复十次,直到识别出每五个碱基中的两个。此时,通过去除所有连接的探针重置整个链,并且重复探针结合,连接,成像和切割的过程四次,每次锚定序列具有n+1,n+2,n+3或n+4的移动。
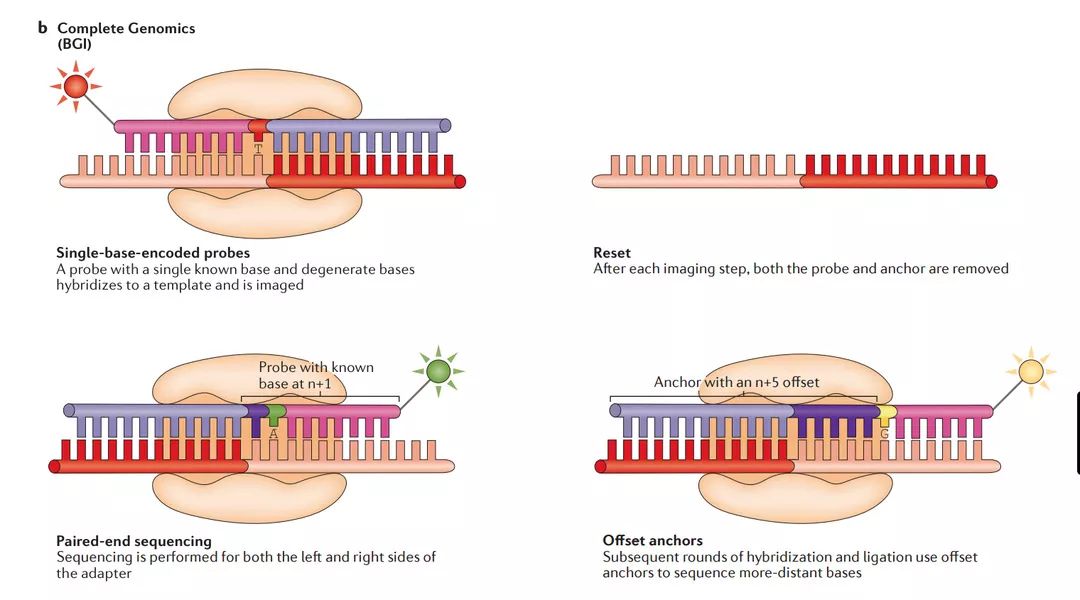
b | 完整基因组学
使用组合探针-锚定连接(cPAL)方法对DNA进行测序。在DNA纳米球沉积后,与四个衔接子序列之一互补的锚定序列和荧光团标记的探针与每个纳米球结合。除第一个位置外,探头完全退化。然后将锚定序列和探针结扎到位并成像以识别锚的3'或5'侧的第一个碱基。接下来,移除探-锚定序列复合物,并且使用相同的锚定序列再次开始该过程,但是具有在n +1位置处的已知碱基的不同探针。重复这一过程,直到锚的3'末端的5个碱基和锚的5'末端的5个碱基被鉴定。发生另一轮杂交,这次使用具有五碱基偏移的锚定序列,在锚定序列的任一侧识别另外五个碱基。最后,对纳米球中剩余的三个衔接子序列中的每一个重复该整个过程,产生100bp配对末端读数。
③基于合成测序(SBA)
SBS是用于描述文献中许多DNA聚合酶依赖性方法的术语,但它没有描述SBS方法中涉及的不同机制。对于本文,SBS方法将被分类为循环可逆终止(CRT)或单核苷酸添加(SNA)。
循环可逆终止(CRT)测序原理
四种dNTP被不同的荧光标记,每个循环就结合一个互补的碱基,拍四次照,四个照片重合,出现哪种荧光标记就可以确定是哪个碱基。反应之后荧光基团会被切除,这样就露出了3’羟基基团(-OH),可以与下一个碱基连接。
a | llumina
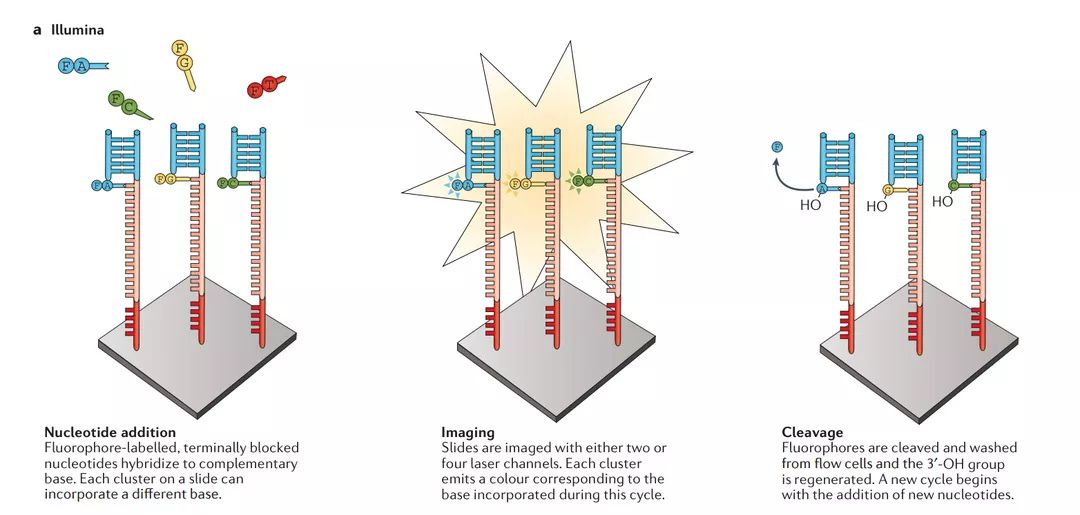
在固相模板富集后,将引物,DNA聚合酶和修饰的核苷酸的混合物添加到流动池中。每个核苷酸被3'-O-叠氮基甲基封闭,并用碱特异性可切割的荧光团(F)标记。在每个循环期间,每个簇中的片段将仅包含一个核苷酸,因为封闭的3'基团阻止额外的掺入。在碱基掺入后,洗去未掺入的碱基,并使用两个或四个激光通道通过全内反射荧光(TIRF)显微镜对载玻片成像,进一步确定了哪个碱基纳入每个集群。然后切割染料和3'-OH,用还原剂TCEP再生。然后再次开始核苷酸添加,延伸和切割的循环。
b | Qiagen
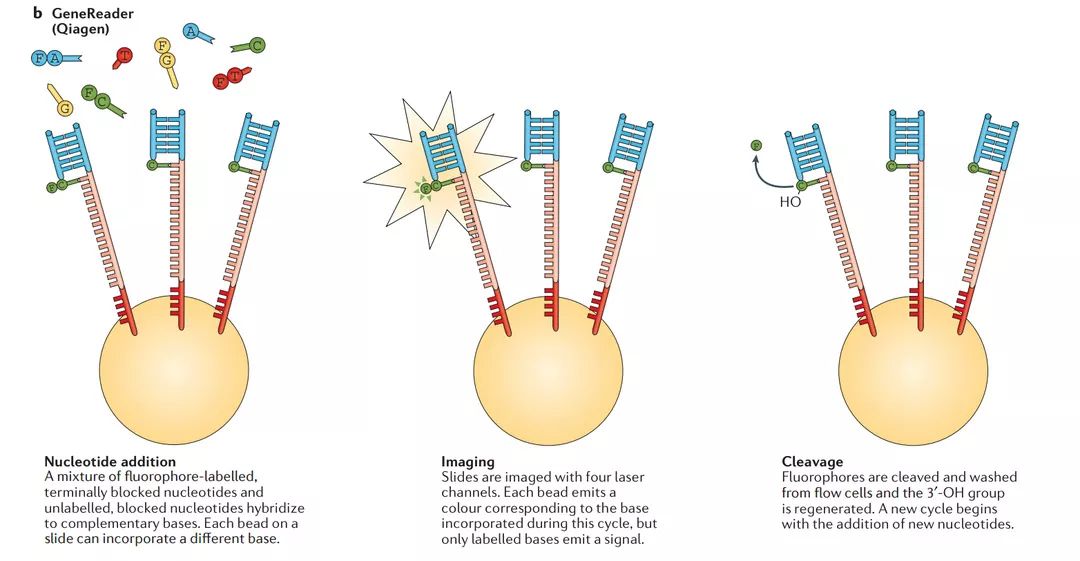
在基于珠子的模板富集后,将引物,DNA聚合酶和修饰的核苷酸的混合物添加到流动池中。每个核苷酸被3'-O-烯丙基封闭,并且一些具有碱基特异性、可切割的荧光团标记。在碱基掺入后,洗去未掺入的碱基,并使用四个激光通道通过TIRF对载玻片成像。然后裂解染料并用钯和TPPTS的还原剂混合物再生3'-OH。
单碱基添加(SNA)原理
454焦磷酸测序和Ion Torrent都属于这种测序原理。SNA的方法依赖单个信号来标记每个测序的碱基。因为它不能终止反应,所以每次只能允许进一种碱基来防止继续延长。这样要是单碱基重复就会继续读取。
a | 454焦磷酸测序
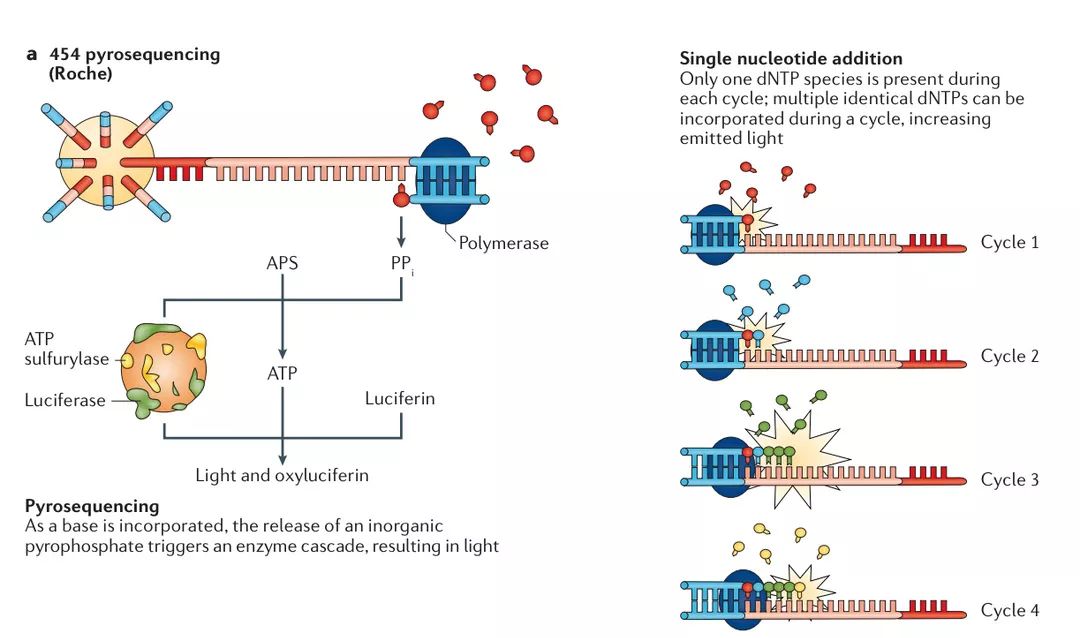
基于珠子的模板富集之后,将珠子与引物和其余含有酶混合物的珠子一起排列在微量滴定板上。在第一个循环期间,将单个核苷酸物质加入板中,并通过DNA聚合酶将每个互补碱基掺入新合成的链中。该反应的副产物是焦磷酸盐分子(PPi)。 PPi分子与ATP硫酸化酶一起将腺苷5'磷酸硫酸盐(APS)转化为ATP。反过来,ATP是荧光素酶将荧光素转化为氧化荧光素的辅助因子,副产物是荧光。最后,腺苷三磷酸双磷酸酶用于降解任何未掺入的碱基,并将下一个碱基加入孔中。由电荷耦合器件(CCD)相机检测的每个光脉冲可确定在特定珠子处掺入一个或多个碱基。
b | Ion Torrent
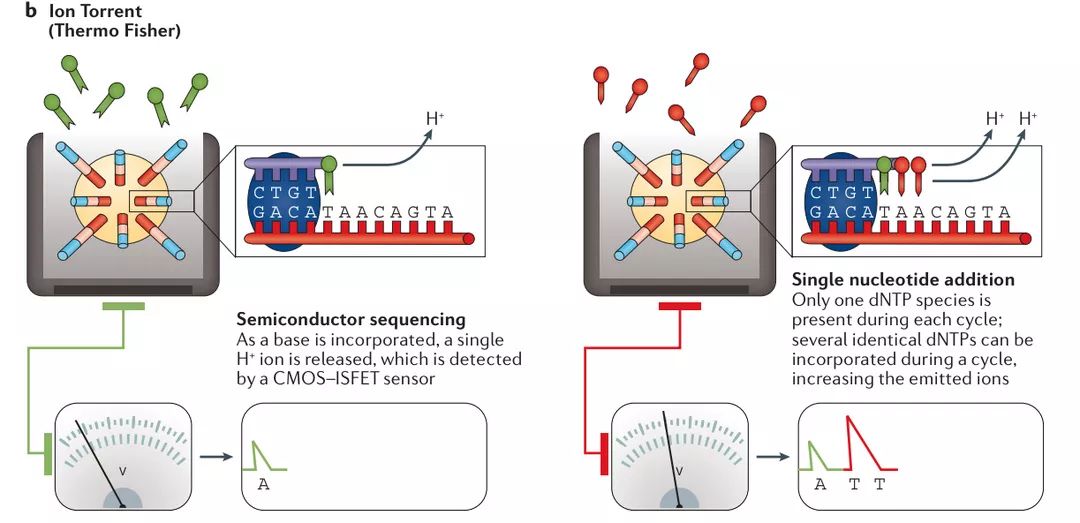
在基于珠子的模板富集之后,将珠子小心地排列到微量滴定板中,其中一个珠子占据单个反应孔。将核苷酸种类一次一个地添加到孔中并进行标准延伸反应。当掺入每种碱基时,产生单一的H +离子作为副产物。 H +释放导致pH值的单位发生变化,由集成的互补金属氧化物半导体(CMOS)和离子敏感的场效应晶体管(ISFET)器件检测。在引入单核苷酸种类后,洗去未掺入的碱基,然后加入下一种碱基。
2
长序列读长测序可提供超过几千碱基的读数,从而可以分辨核苷酸大型结构特征。这种长读取可以通过单次连续读取跨越复杂或重复区域,从而消除基因组元件的位置或大小的模糊性。长读取也可用于转录组学研究,因为它们能够跨越整个mRNA转录本,允许识别外显子的精确连接和识别基因同种型。目前,有两种主要类型的长读取技术:单分子实时测序方法和依赖现有短读技术在计算机中构建长读取的合成方法。
①单分子实时测序
Aa | Pacific Biosciences(PacBio)
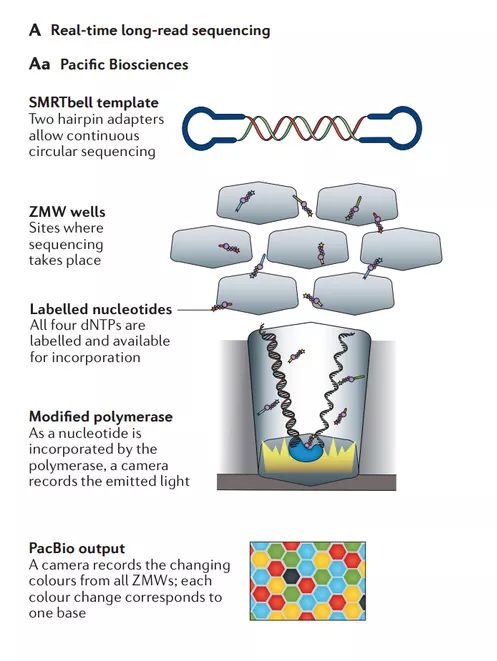
单分子实时(SMRT)测序。将模板片段加工并连接到每个末端的发夹衔接子上,得到环状DNA分子,每个末端具有恒定的单链DNA(ssDNA)区域,中间具有双链DNA(dsDNA)模板。得到的“SMRTbell”模板经历尺寸选择过程,其中去除太大或太小的片段以确保有效的测序。引物和φ29DNA聚合酶连接到SMRTbell的ssDNA区域。然后将制备的文库添加到零模式波导(ZMW)SMRT室中,其中可以进行测序。为了使测序可视化,添加标记核苷酸的混合物;当聚合酶结合的DNA文库位于SMRT细胞的一个孔中时,聚合酶将荧光团标记的核苷酸掺入延伸的DNA链中。在掺入期间,核苷酸暂时通过ZMW底部的聚合酶活性暂停,其由相机监测。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发