癌症免疫治疗背景知识
| 导读 | 癌症是人类健康的重大威胁。一直以来,人类尝试各种手段来对抗癌症,但是由于各种原因,已有手段的效果一直不尽如人意。如今,免疫治疗正为癌症治疗领域带根本性的改变,这种改变不仅体现在临床治疗效果上,甚至体现在思维方式上。 |
一、基本概念
癌症是人类健康的重大威胁。一直以来,人类尝试各种手段来对抗癌症,例如手术、放疗、化疗等等,由于各种原因,这些手段的效果一直不尽如人意。
实际上,人体的免疫系统本身就可以识别和清除突变细胞,维持体内环境的稳定。但是,在癌症发生过程中,癌细胞会利用多种方式逃脱机体的监视。癌症的免疫治疗就是利用技术手段将免疫系统重新激活,使其能够识别癌细胞并将其清除。
由于基因和环境的共同作用,免疫细胞群体是人体内最具有异质性细胞群体之一;另一方面,癌细胞存在基因组不稳定性,各种突变的长期积累也使癌细胞也具有高度的异质性。要弄清这两个高度异质性的细胞群体之间的相互作用,其难度可想而知。
在过去的二十年中,学界一直对免疫系统在癌症发生过程中扮演的角色进行激烈争论。早期人们提出了“免疫监视”(Immunologic Surveillance)的理论。随着研究的不断深入人们发现,癌细胞在机体内发生、发展实际上是免疫系统与癌细胞相互作用的动态过程。免疫系统不仅可以预防或抑制肿瘤的发生,也可以具有重塑癌细胞的免疫原性的功能。人们把这一复杂的过程归纳为“免疫编辑”(Immuno-editing)。
“免疫编辑”理论认为,免疫系统与癌细胞的相互关系可以分为三种不同的状态--清除(Elimination)、平衡(Equilibration)和逃逸(Escape)。

机体新产生的突变细胞具有较强的抗原性,免疫系统可以识别并将其清除。非特异的先天性免疫机制(如吞噬细胞,NK细胞等)和特异的获得性免疫机制(如CD4+T细胞,CD8+T细胞)都参与了该过程。所以,传统理论所说的“免疫监视”,其实只是癌细胞和免疫系统相互作用的第一步。
如果清除过程彻底,癌细胞会被完全排除,免疫编辑就此终止;由于癌细胞具有很大的异质性,有时一些细胞会因为免疫原性减弱等原因未被有效清除,它们与免疫系统的关系就有可能进入第二种状态,即“平衡”(Equilibration)状态。
平衡(Equilibration)
进入此阶段的癌细胞抗原性减弱,因而不会轻易被免疫系统识别和清除,但又时时处在免疫系统的清除压力下,不能过度生长。特异的获得性免疫是维持这种平衡状态的主要机制,一般认为天然免疫机制不参与这个过程。免疫系统和癌细胞的这种平衡状态可以维持几年、十几年甚至终身都不发生变化。
因此,免疫编辑的平衡状态实际上就是一种带瘤生存状态。目前,虽然该理论已经得到很多基于小鼠实验和临床数据的间接支持,直接检测隐藏于小鼠或者人组织中处于平衡阶段的癌细胞仍然是一个巨大的挑战。这需要影像学技术的进一步发展以及相关Biomarker的深入研究。另外,这种“平衡”状态是动态的,由于基因组不稳定性,癌细胞会继续发生突变,免疫系统的选择压力会使有利于癌细胞存活和增殖的突变得到积累。当这种基因突变产生的“积累效应”达到一定程度时,就可能打破平稳,使免疫系统与肿瘤的关系进入“逃逸”(Escape)状态。
逃逸(Escape)
肿瘤细胞逃逸免疫系统的方式多种多样,其中包括:
1)降低肿瘤细胞的免疫原性。例如:癌症强抗原的丢失、MHC分子或者共激活分子丢失或失活。
2)获得更强的抵抗裂解的能力,使癌细胞在免疫细胞的攻击下得以存活。
3)免疫抑制性肿瘤微环境的建立。例如通过VEGF、TGF-beta等细胞因子的分泌调节免疫细胞的功能;或者通过PD-1/PD-L1,CTLA4,Tim-3/Galectin-9,LAG-3等免疫检查点(Immune Checkpoint)分子,抑制细胞免疫反应。近年来,此领域的研究非常活跃,不断有新的免疫检查点分子被发现,例如adenosine Receptors, B7 家族成员,BTLA等等。
实际上,这三个阶段也并不是严格分开的,反应的是免疫系统与肿瘤细胞相互作用的的连续过程。具体情况会随着免疫系统和癌细胞各自状态的改变,而在不同的状态之间转变。
虽然仍然存在争议,但是该理论已经得到了越来越多的实验数据和临床结果的支持。目前,免疫编辑理论是我们理解免疫系统保护机体和塑造癌细胞双重功能的最佳模型,也是我们研究癌症免疫治疗的重要理论基础。
由于癌症细胞逃脱的机制复杂性,免疫治疗的技术手段也多种多样。依据原理的不同,当今的癌症免疫治疗手段大体分为以下几种:非特异性免疫治疗、肿瘤疫苗、免疫检查点阻断和免疫细胞治疗等。
1)非特异性免疫治疗
对细胞直接给予相关细胞因子可能达到调节免疫细胞激活、增殖的作用。目前有几种重组细胞因子被美国食品与药物管理局(FDA)批准用于抗肿瘤免疫刺激剂,如IFN-α2a、IFN-α2b和IL-2等。
2)肿瘤疫苗
利用肿瘤细胞或肿瘤抗原物质诱导机体的特异性细胞免疫和体液免疫反应,激活患者自身免疫系统,增强机体的抗癌能力,从而阻止肿瘤的生长、扩散和复发,以达到清除或控制肿瘤的目的。
虽然在理论上很具有吸引力,但是实际临床表现大多并不理想。目前为止只有少数疫苗(例如Sipuleucel-T)的三期临床实验表明其可以延长癌症病人的生存期。而对于肺癌、肾细胞癌、黑色素瘤的等疫苗的临床研究目前还没有定论。
3)免疫检查点阻断(Immune Checkpoint Blockade)
免疫检查点阻断,就是利用药物(一般是抗体或)阻断T细胞表面CTLA-4、PD-1受体,使其停止接受来自癌细胞或者其他免疫调节细胞的抑制信号而重新激活。实际上,就是通过这种方式逆转免疫编辑的“逃逸”的过程,使肿瘤细胞重新被免疫系统所识别和消灭。
临床实验确切表明,针对CTLA-4,PD-1,PD-L1等检查点分子的抗体在多种癌症病例中具有不错的治疗效果。例如:nivolumab,一个PD-1的抗体药物,其三期临床数据表明,该抗体药物在黑色素瘤病人中的客观反应率(Objective response rate)达到了30%,只有5%的病人具有较为严重的不良反应;而对于发生转移的非BRAF突变型黑色素瘤的临床实验表明,该药物可以将一年生存率从42.1%提升至72.9%;


一项耶鲁大学的基于临床样本的研究数据表明,在体内同时阻断CTLA-4和 PD-1,或者其中的一个都会引起T细胞和单核细胞在基因表达和细胞功能等方面完全不同的变化。其中不但涉及到编码基因的表达变化,还涉及到可变剪接转录本以及非编码RNA的表达变化。
值得一提的是,研究中利用了近年来兴起的质谱流式技术(mass cytometry),同时检测细胞上19个表面Marker的表达,对各种免疫细胞进行精细分群。据此,研究人员发现了两种药物作用机制的不同:CTLA-4可以诱导一个过渡性记忆T细胞(transitional memory T cells)亚群的细胞增殖;而PD-1则主要诱导与细胞裂解相关的蛋白的表达。
由此也可以看出,免疫检查点药物的作用机制是非常复杂的,还需要进一步的深入研究。
4)免疫细胞治疗
免疫细胞治疗是指利用生物工程的方法对病人的免疫细胞进行体外扩增培养和处理,增强其免疫活性,帮助免疫系统识别和杀死体内的肿瘤细胞。用于免疫治疗的细胞种类很多,DC、NK、CIK、T细胞等细胞均曾经被采用。目前最受关注的,就是基于T细胞的CAR-T细胞治疗。
要进行CAR-T细胞治疗,首先需要从病人身体中获得T细胞,然后利用基因工程手段让病人T细胞表达这种CAR受体,经过培养、扩增后再回输到病人体内。这样,CAR-T可以特异识别和攻击体内癌细胞,从而达到治疗的目的。

免疫治疗正为癌症治疗领域带根本性的改变,这种改变不仅体现在临床治疗效果上,甚至体现在思维方式上。然而,创新总是伴随着挑战,免疫治疗也面临着很多重大问题需要进一步研究和解决。
1)肿瘤免疫的基础研究有待深入
肿瘤免疫研究中最大的挑战在于,免疫系统和肿瘤都是高度异质性、不断动态变化的细胞群体,所以肿瘤免疫治疗过程中涉及到大量不同类型细胞间的相互作用。传统的基因组学、蛋白组学等只能检测细胞总体情况,这些数据对于研究这样复杂的群体作用是极为有限的,有时甚至会对研究者产生误导,因为在一些免疫反应中,起决定作用的往往是群体中的少部分细胞。
例如:目前,很多的免疫治疗手段都依赖于T细胞,包括immuno-checkpoint blockade以及CAR-T等。我们知道,T细胞有很多不同的亚群,而这些亚群的功能也各不相同。究竟哪些T细胞亚群在肿瘤免疫起到最主要的作用,目前不完全清楚;除了T细胞以外,浸润于肿瘤组织中的免疫细胞还有MDSC(髓原性抑制细胞)、DC细胞、单核细胞以及粒细胞等等,这些免疫细胞的亚群构成和相互作用也十分复杂,需要进行深入的研究和分析。

2)免疫治疗抗性的产生(Resistance)
免疫治疗过程中引发的抗性也是未来要面对的挑战。虽然目前此方面没有还没有大规模的针对性研究,但是在临床实验中,已经发现确切的产生抗性的病例。
免疫治疗产生抗性的机制主要有两种:第一种,是癌细胞由于基因变异或者表观遗传学的变化,导致少量抗性细胞的产生。这些细胞会在免疫治疗的选择压力下,逐步成长为优势细胞群体,从而表现出临床上的抗性;例如,在部分经过T细胞相关免疫治疗的病人中,发现了B2M分子的缺失。B2M是MHC I分子递呈抗原所必需的,它的缺失会造成肿瘤细胞对T细胞的抗性。
另一种机制,有时在免疫细胞以及其分泌的各种因子的作用下,肿瘤细胞可以调节其基因表达,进而获得对免疫细胞的抗性。这种机制类似于正常组织的免疫耐受反应,因此被称作“自我平衡抗性”(homeostatic resistance)。例如,在T细胞的产物IFNr的作用下,有的肿瘤细胞会诱导表达PD-L1,而PD-L1 会通过与T细胞PD-1受体相互作用抑制其作用。
在研究抗性产生方面,单细胞细胞分析技术也可以发挥非常重要的作用。以范德堡大学开展的AML的临床跟踪研究为例。Jonathan Irish的研究小组利用质谱流式(Mass Cytometry)分析了病人治疗前后骨髓样本细胞组成的变化。通过比较治疗前后病人骨髓样本的viSNE图谱可以看出明显不同:红圈内的细胞在治疗前比例并不大,但是治疗后却发展为主要的原始细胞亚群。
比例大幅增加的这部分细胞其实就是耐药性细胞。由此研究者还可以更加深入的研究这群细胞的表型和功能。虽然这个例子中提到“治疗”还是传统的化疗手段,但是类似的分析也可以在免疫治疗的过程中开展。

3)免疫治疗的副作用(Side Effect)
总体上讲,免疫检查点阻断、CAR-T等免疫治疗手段都是精确的靶向性治疗,相比化疗等常规的治疗手段,其副作用发生频率、严重程度都有明显改善。但是也不排除一些严重的、甚至危急病人生命的不良反应。
以免疫检查点阻断类药物为例,ipilimumab (CTLA-4抗体)是最早进行临床实验、并被FDA批准上市的该类药物。除了介导肿瘤细胞的逃逸外,CTLA-4等免疫检查点分子也在正常组织免疫耐受过程中发挥着重要作用,形象地说,它们在免疫反应中起到“刹车”的作用。CTLA的抗体的出现阻止了这一“刹车”过程,因而造成一系列自身免疫表征。临床上把这种副作用统称为“免疫相关不良事件”(Immune related adverse events,简称irAEs),它的发生率大约为15%~30%,具体表现有发热、大肠、皮肤、肝脏等处的炎症和损伤,个别严重的会导致病人死亡。另一个免疫检查点阻断药物,Nivolumab(PD-1抗体)情况要好一些,临床数据表明,在接受Nivolumab治疗的病人(PD-1抗体)中,大约有5%的病例会发生较为严重的不良反应。其他药物例如LAG-3抗体等,因为还在临床实验中,其在临床上副作用尚不清楚。
另一个典型的例子是CAR-T治疗,虽然在治疗淋巴癌的危重病人方面具有非常显著的疗效,但是它的副作用也非常明显,这主要体现在两个方面:首先是“细胞因子风暴”(Cytokine Storm),在体内的大量CAR-T细胞的激活会导致大量炎症因子的释放,造成患者高烧、头痛、血压过低,严重者会导致肺水肿甚至死亡。另一方面,CAR-T所识别的肿瘤抗原往往也存在于一些正常细胞上,这也会造成不良反应。例如目前最成功的治疗B淋巴癌的靶点是CD19,CART细胞会识别和清除正常的B细胞。
单细胞分析技术可以从病人有限的样本中全面了解其免疫系统的状态。下图是一个为研究CD19 CAR-T细胞治疗而设计的一个质谱流式检测Panel。通过近40个通道的检测,从一份血样中我们可以知道病人外周血中T细胞、B细胞各亚群的增殖、周期、凋亡等状态信息,也可以随时了解CD19 CAR-T细胞在人体中的存续情况和功能信息。这些信息对于研究和预测免疫治疗中副反应发生的频率和强烈程度有着重要的指导作用。

由于基因不稳定性等原因,显著的个体性差异是癌症的突出特点。相关临床数据也表明,病人对免疫治疗的反应也有显著的个体差异,即使是在治疗效果较好的癌症类型中(例如黑色素瘤等),也存在一些完全无效的病例。此外,在治疗过程中,不同病人的不良反应、对治疗产生抗性的情况也不尽相同。因此,个体化治疗,是免疫治疗未来重要的发展方向。

癌症是人类健康的重大威胁。一直以来,人类尝试各种手段来对抗癌症,例如手术、放疗、化疗等等,由于各种原因,这些手段的效果一直不尽如人意。
实际上,人体的免疫系统本身就可以识别和清除突变细胞,维持体内环境的稳定。但是,在癌症发生过程中,癌细胞会利用多种方式逃脱机体的监视。癌症的免疫治疗就是利用技术手段将免疫系统重新激活,使其能够识别癌细胞并将其清除。
总体上说,相比传统的治疗方法,免疫治疗对人体的伤害相对较小,在癌细胞的清除效率和避免复发等方面也有较大的提升。近几年来相关研究逐渐升温,已经成为癌症治疗领域的研究热点。
二、免疫与癌症:两个异质性细胞群体间的复杂关系由于基因和环境的共同作用,免疫细胞群体是人体内最具有异质性细胞群体之一;另一方面,癌细胞存在基因组不稳定性,各种突变的长期积累也使癌细胞也具有高度的异质性。要弄清这两个高度异质性的细胞群体之间的相互作用,其难度可想而知。
在过去的二十年中,学界一直对免疫系统在癌症发生过程中扮演的角色进行激烈争论。早期人们提出了“免疫监视”(Immunologic Surveillance)的理论。随着研究的不断深入人们发现,癌细胞在机体内发生、发展实际上是免疫系统与癌细胞相互作用的动态过程。免疫系统不仅可以预防或抑制肿瘤的发生,也可以具有重塑癌细胞的免疫原性的功能。人们把这一复杂的过程归纳为“免疫编辑”(Immuno-editing)。
“免疫编辑”理论认为,免疫系统与癌细胞的相互关系可以分为三种不同的状态--清除(Elimination)、平衡(Equilibration)和逃逸(Escape)。

“免疫编辑”(Immuno-editing)理论
清除(Elimination)机体新产生的突变细胞具有较强的抗原性,免疫系统可以识别并将其清除。非特异的先天性免疫机制(如吞噬细胞,NK细胞等)和特异的获得性免疫机制(如CD4+T细胞,CD8+T细胞)都参与了该过程。所以,传统理论所说的“免疫监视”,其实只是癌细胞和免疫系统相互作用的第一步。
如果清除过程彻底,癌细胞会被完全排除,免疫编辑就此终止;由于癌细胞具有很大的异质性,有时一些细胞会因为免疫原性减弱等原因未被有效清除,它们与免疫系统的关系就有可能进入第二种状态,即“平衡”(Equilibration)状态。
平衡(Equilibration)
进入此阶段的癌细胞抗原性减弱,因而不会轻易被免疫系统识别和清除,但又时时处在免疫系统的清除压力下,不能过度生长。特异的获得性免疫是维持这种平衡状态的主要机制,一般认为天然免疫机制不参与这个过程。免疫系统和癌细胞的这种平衡状态可以维持几年、十几年甚至终身都不发生变化。
因此,免疫编辑的平衡状态实际上就是一种带瘤生存状态。目前,虽然该理论已经得到很多基于小鼠实验和临床数据的间接支持,直接检测隐藏于小鼠或者人组织中处于平衡阶段的癌细胞仍然是一个巨大的挑战。这需要影像学技术的进一步发展以及相关Biomarker的深入研究。另外,这种“平衡”状态是动态的,由于基因组不稳定性,癌细胞会继续发生突变,免疫系统的选择压力会使有利于癌细胞存活和增殖的突变得到积累。当这种基因突变产生的“积累效应”达到一定程度时,就可能打破平稳,使免疫系统与肿瘤的关系进入“逃逸”(Escape)状态。
逃逸(Escape)
肿瘤细胞逃逸免疫系统的方式多种多样,其中包括:
1)降低肿瘤细胞的免疫原性。例如:癌症强抗原的丢失、MHC分子或者共激活分子丢失或失活。
2)获得更强的抵抗裂解的能力,使癌细胞在免疫细胞的攻击下得以存活。
3)免疫抑制性肿瘤微环境的建立。例如通过VEGF、TGF-beta等细胞因子的分泌调节免疫细胞的功能;或者通过PD-1/PD-L1,CTLA4,Tim-3/Galectin-9,LAG-3等免疫检查点(Immune Checkpoint)分子,抑制细胞免疫反应。近年来,此领域的研究非常活跃,不断有新的免疫检查点分子被发现,例如adenosine Receptors, B7 家族成员,BTLA等等。
实际上,这三个阶段也并不是严格分开的,反应的是免疫系统与肿瘤细胞相互作用的的连续过程。具体情况会随着免疫系统和癌细胞各自状态的改变,而在不同的状态之间转变。
虽然仍然存在争议,但是该理论已经得到了越来越多的实验数据和临床结果的支持。目前,免疫编辑理论是我们理解免疫系统保护机体和塑造癌细胞双重功能的最佳模型,也是我们研究癌症免疫治疗的重要理论基础。
临床数据表明,病人肿瘤组织中一般都有浸润其中的免疫细胞,它们与肿瘤组织的相互作用就处于上面所说“逃逸”的状态。如何将这种状态逆转,是癌症免疫治疗研究的关键所在。
三、免疫治疗的发展现状由于癌症细胞逃脱的机制复杂性,免疫治疗的技术手段也多种多样。依据原理的不同,当今的癌症免疫治疗手段大体分为以下几种:非特异性免疫治疗、肿瘤疫苗、免疫检查点阻断和免疫细胞治疗等。
1)非特异性免疫治疗
对细胞直接给予相关细胞因子可能达到调节免疫细胞激活、增殖的作用。目前有几种重组细胞因子被美国食品与药物管理局(FDA)批准用于抗肿瘤免疫刺激剂,如IFN-α2a、IFN-α2b和IL-2等。
2)肿瘤疫苗
利用肿瘤细胞或肿瘤抗原物质诱导机体的特异性细胞免疫和体液免疫反应,激活患者自身免疫系统,增强机体的抗癌能力,从而阻止肿瘤的生长、扩散和复发,以达到清除或控制肿瘤的目的。
虽然在理论上很具有吸引力,但是实际临床表现大多并不理想。目前为止只有少数疫苗(例如Sipuleucel-T)的三期临床实验表明其可以延长癌症病人的生存期。而对于肺癌、肾细胞癌、黑色素瘤的等疫苗的临床研究目前还没有定论。
3)免疫检查点阻断(Immune Checkpoint Blockade)
免疫检查点阻断,就是利用药物(一般是抗体或)阻断T细胞表面CTLA-4、PD-1受体,使其停止接受来自癌细胞或者其他免疫调节细胞的抑制信号而重新激活。实际上,就是通过这种方式逆转免疫编辑的“逃逸”的过程,使肿瘤细胞重新被免疫系统所识别和消灭。
临床实验确切表明,针对CTLA-4,PD-1,PD-L1等检查点分子的抗体在多种癌症病例中具有不错的治疗效果。例如:nivolumab,一个PD-1的抗体药物,其三期临床数据表明,该抗体药物在黑色素瘤病人中的客观反应率(Objective response rate)达到了30%,只有5%的病人具有较为严重的不良反应;而对于发生转移的非BRAF突变型黑色素瘤的临床实验表明,该药物可以将一年生存率从42.1%提升至72.9%;

经PDA批准上市的Immune Checkpoint Blockade类药物
从2014年以来,已经有多个免疫检查点阻断先后已经被FDA批准,例如:Ipilimumab(人源抗CTLA-4 IgG1)、Nivolumab 和pembrolizumab(人源抗PD-1 IgG4)等。另外还有多种药物正在进行不同阶段的临床实验,例如针对CTLA-4的Tremenlimumab、针对PDL1的MDX-1105、针对LAG3的IMP321等等。
数量众多的免疫检查点及其配体分子,有可能作为未来新的药物靶点。
目前,免疫检查点阻断药物已经成为当今免疫治疗领域的热点之一,对于其作用机制的深入研究正在全球各地不同的实验室中同时进行。一项耶鲁大学的基于临床样本的研究数据表明,在体内同时阻断CTLA-4和 PD-1,或者其中的一个都会引起T细胞和单核细胞在基因表达和细胞功能等方面完全不同的变化。其中不但涉及到编码基因的表达变化,还涉及到可变剪接转录本以及非编码RNA的表达变化。
值得一提的是,研究中利用了近年来兴起的质谱流式技术(mass cytometry),同时检测细胞上19个表面Marker的表达,对各种免疫细胞进行精细分群。据此,研究人员发现了两种药物作用机制的不同:CTLA-4可以诱导一个过渡性记忆T细胞(transitional memory T cells)亚群的细胞增殖;而PD-1则主要诱导与细胞裂解相关的蛋白的表达。
由此也可以看出,免疫检查点药物的作用机制是非常复杂的,还需要进一步的深入研究。
4)免疫细胞治疗
免疫细胞治疗是指利用生物工程的方法对病人的免疫细胞进行体外扩增培养和处理,增强其免疫活性,帮助免疫系统识别和杀死体内的肿瘤细胞。用于免疫治疗的细胞种类很多,DC、NK、CIK、T细胞等细胞均曾经被采用。目前最受关注的,就是基于T细胞的CAR-T细胞治疗。

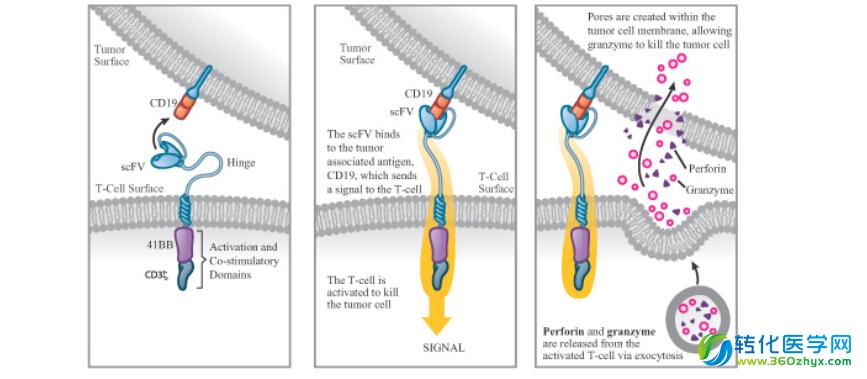
嵌合抗原受体(CAR)的结构及其发挥作用的分子机制
CAR是嵌合抗原受体(chimeric antigen receptors)的简称,它是一种人工改造的特别针对癌细胞抗原的受体。和正常的T细胞受体类似,CAR也是一个跨膜蛋白。其胞外区一般是针对癌细胞抗原(例如CD19胞外区)抗体的scFv区(含有一个表位识别结构域),胞内区则整合了多个与T细胞激活相关的结构域(例如CD3、CD28、OX40等受体的胞内激活性结构域)。要进行CAR-T细胞治疗,首先需要从病人身体中获得T细胞,然后利用基因工程手段让病人T细胞表达这种CAR受体,经过培养、扩增后再回输到病人体内。这样,CAR-T可以特异识别和攻击体内癌细胞,从而达到治疗的目的。

CAR-T治疗的流程
From (2014) Nature Reviews Clinical Oncology
目前,在治疗淋巴癌方面,CAR-T细胞治疗已经初有成效。 以2014年NCI和NIH等机构合作的一项关于Anti-CD19 CAR-T临床研究为例,在18例化疗无效的晚期B细胞恶性肿瘤中,15例病人出现了完全或者部分缓解,部分病人的缓解时间可以持续时间达9~22个月。同年年底的美国血液学年会(ASH)中,Juno Therapeutics 报告了他们的CART一期临床实验结果,在27例难治型急淋病人中,24例获得了缓解,6例病人的无病生存时间长达一年以上。无疑,CAR-T为癌症治疗带来了新的希望,自然也成为了国内外各机构、公司的研究热点。目前,Novatis、Cellectis、Kite Pharma 、Amgen等公司都投入巨资进入相关领域的研究。尽管还存在一些问题有待攻克(例如CAR-T会引发细胞因子风暴),其应用前景不容小觑。
四、未来的挑战及其应对免疫治疗正为癌症治疗领域带根本性的改变,这种改变不仅体现在临床治疗效果上,甚至体现在思维方式上。然而,创新总是伴随着挑战,免疫治疗也面临着很多重大问题需要进一步研究和解决。
1)肿瘤免疫的基础研究有待深入
肿瘤免疫研究中最大的挑战在于,免疫系统和肿瘤都是高度异质性、不断动态变化的细胞群体,所以肿瘤免疫治疗过程中涉及到大量不同类型细胞间的相互作用。传统的基因组学、蛋白组学等只能检测细胞总体情况,这些数据对于研究这样复杂的群体作用是极为有限的,有时甚至会对研究者产生误导,因为在一些免疫反应中,起决定作用的往往是群体中的少部分细胞。
例如:目前,很多的免疫治疗手段都依赖于T细胞,包括immuno-checkpoint blockade以及CAR-T等。我们知道,T细胞有很多不同的亚群,而这些亚群的功能也各不相同。究竟哪些T细胞亚群在肿瘤免疫起到最主要的作用,目前不完全清楚;除了T细胞以外,浸润于肿瘤组织中的免疫细胞还有MDSC(髓原性抑制细胞)、DC细胞、单核细胞以及粒细胞等等,这些免疫细胞的亚群构成和相互作用也十分复杂,需要进行深入的研究和分析。

肿瘤组织具有高度的异质性
From (2013) Nature
近年来,单细胞分析技术的兴起有力的支持了肿瘤免疫领域基础研究的深入。单细胞测序技术使得大规模研究单细胞基因组和转录组成为了可能。研究者能够以单细胞的分辨率研究癌细胞内基因突变的积累以及免疫细胞中TCR、BCR等基因的重排,或者肿瘤免疫过程中基因表达水平的变化;在蛋白水平,质谱流式技术(Mass Cytometry)的发展把多参数的单细胞分析扩展到了蛋白水平,研究者可以精细分析免疫细胞和癌细胞的亚群,同时观察其胞内各种与其功能相关的细胞因子、信号通路、转录因子等表达和修饰情况。2)免疫治疗抗性的产生(Resistance)
免疫治疗过程中引发的抗性也是未来要面对的挑战。虽然目前此方面没有还没有大规模的针对性研究,但是在临床实验中,已经发现确切的产生抗性的病例。
免疫治疗产生抗性的机制主要有两种:第一种,是癌细胞由于基因变异或者表观遗传学的变化,导致少量抗性细胞的产生。这些细胞会在免疫治疗的选择压力下,逐步成长为优势细胞群体,从而表现出临床上的抗性;例如,在部分经过T细胞相关免疫治疗的病人中,发现了B2M分子的缺失。B2M是MHC I分子递呈抗原所必需的,它的缺失会造成肿瘤细胞对T细胞的抗性。
另一种机制,有时在免疫细胞以及其分泌的各种因子的作用下,肿瘤细胞可以调节其基因表达,进而获得对免疫细胞的抗性。这种机制类似于正常组织的免疫耐受反应,因此被称作“自我平衡抗性”(homeostatic resistance)。例如,在T细胞的产物IFNr的作用下,有的肿瘤细胞会诱导表达PD-L1,而PD-L1 会通过与T细胞PD-1受体相互作用抑制其作用。
在研究抗性产生方面,单细胞细胞分析技术也可以发挥非常重要的作用。以范德堡大学开展的AML的临床跟踪研究为例。Jonathan Irish的研究小组利用质谱流式(Mass Cytometry)分析了病人治疗前后骨髓样本细胞组成的变化。通过比较治疗前后病人骨髓样本的viSNE图谱可以看出明显不同:红圈内的细胞在治疗前比例并不大,但是治疗后却发展为主要的原始细胞亚群。
比例大幅增加的这部分细胞其实就是耐药性细胞。由此研究者还可以更加深入的研究这群细胞的表型和功能。虽然这个例子中提到“治疗”还是传统的化疗手段,但是类似的分析也可以在免疫治疗的过程中开展。

AML病人治疗前后骨髓细胞viSNE图谱的变化
viSNE图中每个点代表一个细胞,位置反映了该细胞Marker表达模式,两个细胞在图中越靠近,就代表细胞表型越相似。注意红色框中的原始细胞在治疗后比例明显增大。3)免疫治疗的副作用(Side Effect)
总体上讲,免疫检查点阻断、CAR-T等免疫治疗手段都是精确的靶向性治疗,相比化疗等常规的治疗手段,其副作用发生频率、严重程度都有明显改善。但是也不排除一些严重的、甚至危急病人生命的不良反应。
以免疫检查点阻断类药物为例,ipilimumab (CTLA-4抗体)是最早进行临床实验、并被FDA批准上市的该类药物。除了介导肿瘤细胞的逃逸外,CTLA-4等免疫检查点分子也在正常组织免疫耐受过程中发挥着重要作用,形象地说,它们在免疫反应中起到“刹车”的作用。CTLA的抗体的出现阻止了这一“刹车”过程,因而造成一系列自身免疫表征。临床上把这种副作用统称为“免疫相关不良事件”(Immune related adverse events,简称irAEs),它的发生率大约为15%~30%,具体表现有发热、大肠、皮肤、肝脏等处的炎症和损伤,个别严重的会导致病人死亡。另一个免疫检查点阻断药物,Nivolumab(PD-1抗体)情况要好一些,临床数据表明,在接受Nivolumab治疗的病人(PD-1抗体)中,大约有5%的病例会发生较为严重的不良反应。其他药物例如LAG-3抗体等,因为还在临床实验中,其在临床上副作用尚不清楚。
另一个典型的例子是CAR-T治疗,虽然在治疗淋巴癌的危重病人方面具有非常显著的疗效,但是它的副作用也非常明显,这主要体现在两个方面:首先是“细胞因子风暴”(Cytokine Storm),在体内的大量CAR-T细胞的激活会导致大量炎症因子的释放,造成患者高烧、头痛、血压过低,严重者会导致肺水肿甚至死亡。另一方面,CAR-T所识别的肿瘤抗原往往也存在于一些正常细胞上,这也会造成不良反应。例如目前最成功的治疗B淋巴癌的靶点是CD19,CART细胞会识别和清除正常的B细胞。
单细胞分析技术可以从病人有限的样本中全面了解其免疫系统的状态。下图是一个为研究CD19 CAR-T细胞治疗而设计的一个质谱流式检测Panel。通过近40个通道的检测,从一份血样中我们可以知道病人外周血中T细胞、B细胞各亚群的增殖、周期、凋亡等状态信息,也可以随时了解CD19 CAR-T细胞在人体中的存续情况和功能信息。这些信息对于研究和预测免疫治疗中副反应发生的频率和强烈程度有着重要的指导作用。

质谱流式可以从病人样本获得大量表型和功能信息
4)个体化治疗(Personalized Therapy)由于基因不稳定性等原因,显著的个体性差异是癌症的突出特点。相关临床数据也表明,病人对免疫治疗的反应也有显著的个体差异,即使是在治疗效果较好的癌症类型中(例如黑色素瘤等),也存在一些完全无效的病例。此外,在治疗过程中,不同病人的不良反应、对治疗产生抗性的情况也不尽相同。因此,个体化治疗,是免疫治疗未来重要的发展方向。

实现个体化治疗是癌症免疫治疗的重要目标
要解决这一问题,我们除了需要了解各种药物、治疗手段的更精细的分子机制以外,还需要找到一系列可以预测治疗过程中病人各种反应的Biomarker。这是一个庞大的系统工程,要求我们能够从病人有限的样本中收集大量的分子生物学信息,充分了解病人个体间的差异性,并与临床数据分析对照,找到其中的相关性。要完成这一构想,需要多学科、多种不同技术的综合应用。二代测序及其相关技术可以检测出样本的基因突变、基因表达变化;质谱流式技术则可以在蛋白水平精细分析样本细胞的亚群组成、信号通路状态;此外,一些新的成像技术,例如在质谱流式基础上发展而来的Imaging Mass Cytometry(成像质谱流式),通过对组织切片几十种蛋白的成像,可以帮助我们详细了解病人肿瘤组织中浸润的免疫细胞的分布、比例和状态。利用生物信息学方法可以将这些数据与临床数据进行整合和分析,就有可能帮助我们找到对临床有指导意义的Biomarker。(更多相关细节参见本专题的其他文章。)
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发